晚期胃癌药研步入精确滴灌期
发布时间:2025-03-24 10:26:27作者:秦卫华来源:医药经济报
胃癌是我国高发的消化系统恶性肿瘤,据GLOBOCAN 2022年的数据,全球约37%的新发病例来自中国。30%~40%的患者确诊时已处于晚期或转移阶段,5年生存率仅为5%~20%。由于其高度异质性,胃癌的分子分型逐渐成为精准治疗的核心,也对临床试验设计提出了更高要求。
近期,国家药监局药品审评中心(CDE)正式发布《晚期胃癌新药临床试验设计指导原则》(以下简称《指导原则》),旨在解决此前指导原则未能覆盖的晚期胃癌临床试验设计难点,如生物标志物应用、终点选择及研究设计创新等,标志着中国抗肿瘤药物研发进入更精细化、规范化的阶段。
分子机制脉络逐渐明晰
胃癌与多种表观遗传和遗传因素有关,分子特征广泛。推动对胃癌复杂分子机制的深入理解,对于提升治疗准确度和改善患者结局至关重要。目前,学界认为其分子机制包括:基因突变和癌基因、肿瘤抑制基因和DNA修复机制、DNA甲基化和组蛋白修饰等。
临床实践方面,2025年,美国国家综合癌症网络(NCCN)指南更新强调,对高级别上皮内瘤变(HGIN)患者应实施多学科诊疗(MDT)模式,推荐每3个月胃镜监测联合血清胃功能检测。对于基因检测提示CDH1基因突变者,建议40岁前实施预防性胃切除术。
值得关注的是,纳米技术已成为一种革命性的进步,具有改变胃癌治疗的潜力。纳米级材料提供了许多益处,例如精确的药物输送,提升治疗效果,降低总体毒性,以及克服耐药性机制的能力。
信号通路异常在胃癌的发生和发展中起重要作用。参与胃癌进展的途径主要有:NF-κB通路、Wnt信号通路、P13K/AKT/MTOR信号通路、HER2信号通路/EGFR、p53信号通路、MAPK信号通路。
近年来,在分子机制研究方面,学界取得不少突破。关于表观遗传调控网络,2023年Nature杂志的一项研究发现,TET2介导的DNA去甲基化异常会导致抑癌基因沉默;2024年,Gastroenterology杂志一项研究则发现,长链非编码RNA H19过表达通过miR-675轴促癌变。
在微生物-宿主互作方面,有研究发现,幽门螺杆菌CagA蛋白诱导SHP2/RAS/ERK通路持续激活,清除幽门螺杆菌能减少胃癌的发生;胃微生物组特征谱研究则发现,乳酸菌丰度与胃癌存在一定相关性。
此外,随着生物标志物研究纵深发展,试验设计更加精准化。《指导原则》明确强调生物标志物在晚期胃癌新药研发中的指导作用。例如,HER2阳性患者可通过曲妥珠单抗等靶向药物显著获益,而PD-L1表达水平则是免疫检查点抑制剂疗效的重要预测指标。Claudin 18.2、FGFR2b等新兴标志物的发现,也进一步推动了针对特定分子亚型药物的开发。
需指出的是,胃癌的异质性导致单一标志物可能无法全面预测疗效。《指导原则》提出需探索联合标志物策略,例如同时检测HER2、微卫星不稳定性(MSI)和肿瘤突变负荷(TMB),以筛选更可能获益的人群。这要求临床试验设计时需整合多组学数据,并采用动态监测技术(如液体活检)优化患者分层。
业内需意识到,当前生物标志物的部分临床应用仍面临标准化不足的问题。例如,不同检测平台的阈值差异可能影响结果一致性。对此,《指导原则》建议采用中心实验室统一检测,并参考国际标准(如CAP/CLIA认证)以确保数据可靠性。
精确优化临床试验设计
《指导原则》对胃癌药物临床研究进行了精确指导。在早期临床试验阶段,《指导原则》体现了灵活性,强调适应性设计(Adaptive Design)的应用。例如,通过剂量递增与扩展队列的并行推进,快速识别有效剂量和潜在获益人群。此外,基于“篮子试验”(Basket Trial)或“伞式试验”(Umbrella Trial)的平台设计,可同时评估同一药物在不同分子亚型中的疗效,提高研发效率。
在确证性试验中,《指导原则》关注关键注册试验的严格性,推荐优先选择随机对照试验(RCT),尤其在与标准治疗对比时需确保对照组选择的合理性。对于罕见突变亚型(如HER2低表达),单臂试验可能被接受,但需结合历史数据或真实世界证据(RWE)支持疗效评估。此外,跨区域多中心试验设计(如遵循ICH E17原则)被鼓励,以增强数据的全球适用性。
《指导原则》也关注到了晚期胃癌治疗新趋势,例如免疫联合化疗、靶向联合抗血管生成等方案。其指出,联合用药试验需明确各成分的贡献度,并通过析因设计或剂量优化研究验证协同作用。例如,KEYNOTE-811研究通过帕博利珠单抗联合化疗显著提升HER2阳性患者的客观缓解率(ORR),为联合方案的设计提供了范例。
在试验终点选择方面,《指导原则》也展现了其科学性与创新性。对于传统终点的局限性,其指出,总生存期(OS)仍为“金标准”,但其受后续治疗干扰较大,且研究周期长、成本高;无进展生存期(PFS)虽能更快反映疗效,但在胃癌中与OS的相关性较弱。因此,《指导原则》建议结合疾病特点灵活选择终点,例如在免疫治疗中采用持续缓解时间(DoR)或至治疗失败时间(TTF)作为补充指标。
对于替代终点,《指导原则》持审慎态度。对于填补治疗空白的药物,《指导原则》允许使用替代终点如ORR加速审批,但需承诺上市后验证临床获益。例如,抗体药物偶联物(ADC)德曲妥珠单抗在DESTINY-Gastric01试验中凭借ORR和DoR数据获附条件批准,后续通过OS验证实现完全批准。
“以患者为中心”的研发理念也逐渐凸显。《指导原则》鼓励将生活质量(QoL)、症状缓解等患者报告结局(PRO)指标纳入终点体系,例如通过EORTC QLQ-STO22量表评估胃癌特异性症状改善,这不仅更全面反映治疗价值,也符合监管机构对“临床获益”定义的扩展。
借技术巧引研究活水
未来,胃癌研究如何取得进一步突破?笔者认为,明晰挑战,才能看清方向。首先,业内需要意识到异质性管理的复杂性。当前,相关生物标志物分子分型仍在不断演进,如何动态更新生物标志物检测标准是一大挑战。《指导原则》建议建立动态数据库,并利用人工智能辅助标志物发现与患者匹配。
其次,重视全球研发的协同性,开展区域特异性研究。例如,《指导原则》鼓励申办方在设计国际多中心试验时纳入足够比例的亚洲患者,以确保数据外推的合理性。
RWE的补充作用也不容忽视。对于单臂试验或罕见亚型研究,RWE可作为历史对照组的重要来源。CDE近期发布的《以患者为中心的临床试验设计技术指导原则》进一步强调,利用真实世界数据(RWD)优化入组标准和终点设定。
随着循环肿瘤DNA(ctDNA)和影像组学的应用,《指导原则》支持探索分子缓解(Molecular Response)或影像学深度缓解(如病理完全缓解率,pCR)等创新终点,以更早预测长期疗效。
未来,药企需调整研发策略,优先布局胃癌分子分型相关靶点(如Claudin 18.2、FGFR2),并加强生物标志物检测能力。同时,需平衡单臂试验的快速审批与随机对照试验的严谨性。
《指导原则》的发布,为行业提供了从生物标志物到终点选择的系统性框架,既回应了当前研发痛点,也为未来创新预留空间。随着精准医学与监管科学的深度融合,晚期胃癌治疗有望从“泛人群”模式转向“细分亚型”模式,最终实现患者生存与生活质量的全面提升。
相关
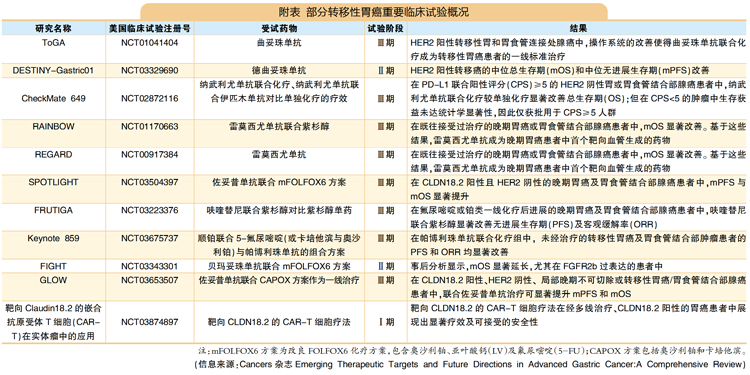
转移性胃癌临床试验里程碑
晚期胃癌往往发生转移,患者预后仍然有较大提升空间,五年生存率低于10%。近年来,转移性胃癌的治疗靶点和相关的临床研究取得一定进展(详见附表)。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






