女性癌症个体化定制疗法各展芳菲
发布时间:2025-03-11 15:16:13作者:张琦来源:医药经济报

癌症在不同性别中的发病倾向与特征存在差异,女性在某些癌症类型上承受着更高的风险。乳腺癌、卵巢癌、子宫内膜癌以及宫颈癌,是女性常见四大癌症。过去30年,恰是医疗科技飞速进步的黄金时期,在女性特异性癌症的新药研发与治疗手段领域,一场悄无声息却震撼人心的变革正在发生,众多前沿成果如璀璨星辰照亮了抗癌之路,为女性患者带来了前所未有的希望。
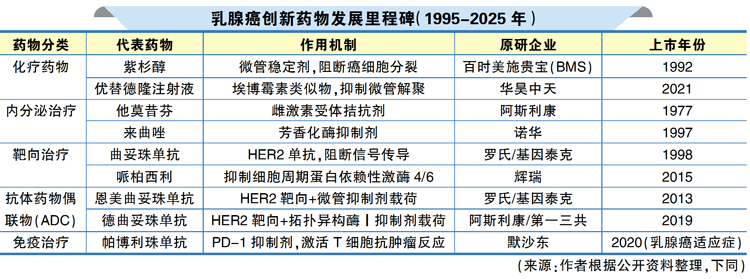
乳腺癌:靶向治疗与精准分型引领创新
乳腺癌是女性最常见的恶性肿瘤之一。在全球范围内,乳腺癌的发病率长期位居女性癌症首位。根据世界卫生组织发布的数据,2022年全球女性新发乳腺癌病例为230万例,占所有癌症新发病例的11.6%。
20世纪70年代,Bernard Fisher提出了乳腺癌是全身性疾病的理论,改变了以往对乳腺癌的认识,促使乳腺癌的治疗模式从单纯的局部治疗转向局部治疗与全身治疗并重,开启了手术、放化疗、内分泌治疗等综合治疗时代。
肿瘤分子分型概念的提出与技术发展,使人们对乳腺癌的认识更为细化。经过多个阶段的完善,最终形成了一套较为成熟和稳定的分型体系,乳腺癌的精准治疗拉开序幕。
现阶段乳腺癌分子分型主要是ER/PR/HER2分型,随着抗体药物偶联物(ADC)德曲妥珠单抗在HER2低表达患者中的卓越表现,此前阳性/阴性二分法也开始迈入更加精准的三分法治疗时代(阳性、低表达、阴性)。
建立在详细了解分型体系之上的药物研究也随之突飞猛进。palbociclib、ribociclib等药物联合内分泌治疗,已成为HR+/HER2-晚期患者的一线方案;新一代口服选择性雌激素受体降解剂(SERD)进一步解决耐药问题。以德曲妥珠单抗为代表的ADC药物崛起,通过靶向HER2并搭载高效化疗载荷,显著延长晚期HER2+和HER2低表达患者的生存期,成为近年最大突破。
最为凶险的三阴性乳腺癌也通过免疫分型和代谢特征研究,逐渐细分出可干预亚群。例如,PD-L1抑制剂联合化疗,可将新辅助治疗的病理完全缓解率提升至56.8%。此外,基因检测与多组学分析,如BRCA1/2突变、PI3K/AKT/mTOR通路异常等基因特征的发现,也推动了PARP抑制剂和AKT抑制剂的临床应用。
30年来,乳腺癌诊疗从“一刀切”迈向分子分型驱动的精准时代,靶向药物、ADC、免疫治疗成为三大支柱。不过,临床仍有未被满足的需求,等待业界探索:如PD-L1抑制剂联合疗法及PARP抑制剂在三阴性乳腺癌治疗中的联合应用,小分子酪氨酸激酶抑制剂(TKI)和突破血脑屏障限制的ADC的研发等。
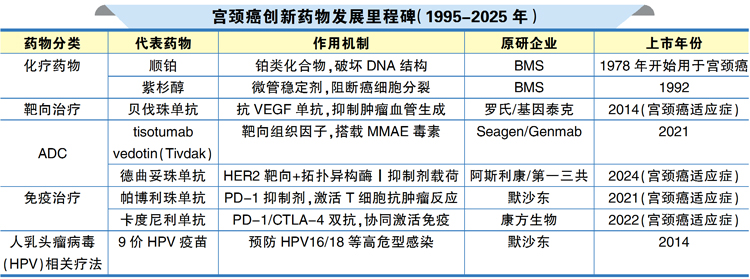
宫颈癌:免疫疗法成为主流
宫颈癌是常见的妇科恶性肿瘤之一,发病率位于女性肿瘤的第二位。与乳腺癌涉及激素、遗传、微环境等更多致病因素相比,宫颈癌与人乳头瘤病毒(HPV)感染强相关,致病机制相对单一,靶点开发空间相对有限。同时,随着宫颈癌疫苗的普及,发病率显著降低,晚期治疗需求相对较小,因此,全球宫颈癌药物研发投入远低于乳腺癌。相关数据显示,其2024年全球在研项目不足200项,而乳腺癌超过1000项。
尽管如此,近10年,随着对HPV致癌机制(如E6/E7蛋白导致p53基因失活)的深入了解,宫颈癌的靶向药物和免疫治疗也取得了突破,逐渐成为宫颈癌治疗的主流。
早期宫颈癌治疗高度依赖手术和放化疗,但复发/转移性患者生存率极低(中位生存期仅6~9个月)。目前,PD-1抑制剂pembrolizumab已经被FDA批准用于治疗PD-L1阳性复发或转移的宫颈癌。ADC药物的适应症也在扩大,比如德曲妥珠单抗在2024年4月被FDA快速批准用于HER2阳性(IHC 3+)宫颈癌,能让75%的患者病情好转。免疫治疗的联合方案也在不断优化,比如KEYNOTE-A18研究的最新结果显示,帕博利珠单抗添加到放化疗中,使患者的3年总生存率提高至82.6%,死亡风险降低了22%,成为局部晚期宫颈癌的新标准治疗方法。
基于HPV感染的病因学特征,研发更倾向预防性疫苗和治疗性疫苗。例如,针对HPV E6/E7抗原的CAR-T疗法和基因编辑技术(如CRISPR)正处于早期临床试验阶段,旨在清除病毒和癌变细胞。
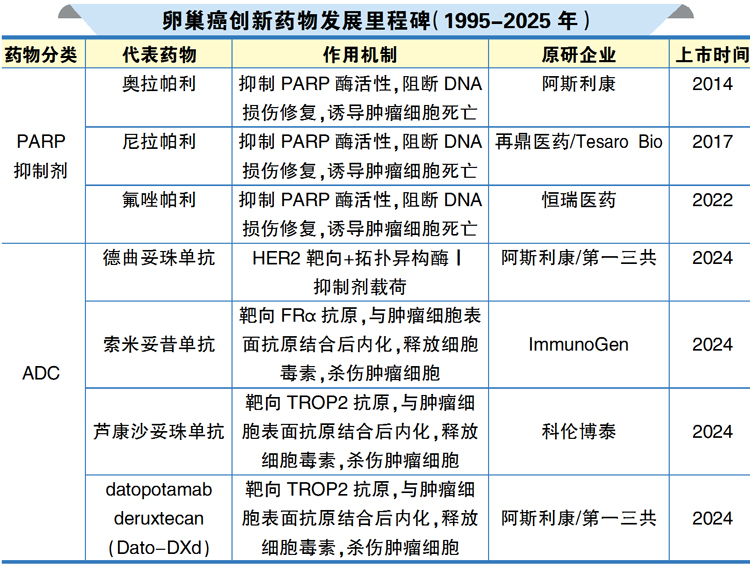
卵巢癌:PARP抑制剂耐药多维破困局
卵巢癌的发病率位居女性生殖系统恶性肿瘤的第三位,但其病死率居妇科恶性肿瘤之首。全球范围内,卵巢癌的发病率存在明显的地域差异,欧洲国家的发病率最高,非洲国家的发病率最低。
手术是卵巢癌的主要治疗手段之一,包括卵巢切除术、腹腔镜手术。对于早期患者,手术可能达到根治的目的,对于晚期患者,手术则主要用于缓解症状和提高生活质量。然而,卵巢癌早期诊断困难,70%患者确诊时已为晚期,且易复发。
化疗是卵巢癌综合治疗的重要组成部分,近年来,靶向药物如贝伐珠单抗、度伐利尤单抗等也被纳入化疗方案中,以提高治疗效果。
新型药物如PARP抑制剂和ADC药物在晚期卵巢癌一线维持治疗中的应用逐渐崭露头角,如奥拉帕利、尼拉帕利等通过“合成致死”机制显著延长无进展生存期,但耐药问题突出。于是,PARP抑制剂联合抗血管生成药(如贝伐珠单抗)、ATR抑制剂(如ceralasertib)或免疫检查点抑制剂,正在临床试验中验证,以求突破耐药瓶颈。
子宫癌:分子分型推动个体化治疗
在女性特异性恶性肿瘤中,子宫癌发病率增长最快。《全球疾病负担2021》数据库显示,2021年子宫癌发病率最高的三个国家是美国、中国、俄罗斯,总计约占全球新发病例的45%。子宫癌以子宫内膜癌为主,分子分型直接影响治疗方案,也驱动着相关药物的研发,治疗高度个体化。
MSI-H亚型通常对免疫检查点抑制剂治疗特别敏感,这些药物通过阻断癌细胞的PD-1受体,可以激活免疫系统的T细胞攻击癌细胞,从而有效控制病情。PD-1抑制剂dostarlimab和Keytruda获批用于MSI-H/dMMR患者,响应率超40%。
PI3K/AKT/mTOR信号通路的异常激活可以抑制细胞凋亡、促进细胞的生长和增殖。在子宫癌中,该信号通路的过度激活会导致细胞周期失控,促进子宫癌细胞的增殖。针对该信号通路的抑制剂已成为子宫癌治疗的研究热点,目前,已有部分PI3K抑制剂、AKT抑制剂和mTOR抑制剂进入临床试验阶段,显示出一定的抗肿瘤活性。
传统的激素疗法也迎来了革新,口服SERD和选择性PR调节剂(如Lynparza)正在挑战孕激素治疗的地位,为子宫癌的治疗带来新的选择。
★★★ 结语 ★★★
女性特异性癌症的创新药研发正在从“粗放式”治疗向“精准化”和“个体化”迈进。然而,克服耐药性、优化生物标志物体系、平衡研发投入仍是长期挑战。未来,耐药机制的破解、新型生物标志物开发、跨学科技术融合,以及全球资源整合协作,将成为破局关键。
相关<<<
药研核心难点透视
在以上四大恶性肿瘤药物研发的征途上,隐藏着若干难点,挑战着医学界的智慧与勇气。
四大难点待突破
首先就是肿瘤异质性与耐药机制复杂,四大癌症均存在高度异质性。更糟糕的是,这些肿瘤细胞还擅长“变装”,通过表观遗传改变、重塑肿瘤微环境等方式,让单一靶点的药物难以持久发挥作用。
其次是生物标志物筛选与验证相对滞后。作为“导航系统”的生物标志物,在四大癌症中,除了乳腺癌中的HER2、卵巢癌中的BRCA等少数“明星”标志物外,大多数新发现的靶点都像是没有配对钥匙的锁。比如FRα的表达水平与肿瘤的侵袭性和预后紧密相关,但目前的检测手段比较有限,检出的准确率有待提高。
相对于其他癌种,这些肿瘤临床前模型的局限性也限制了新药的研发。对于卵巢癌和子宫癌而言,现有的动物模型就像是过于简化的“地图”,无法模拟出人体微环境的复杂多变,导致药物转化率低。而类器官和患者源性异种移植(PDX)模型,应用还需要进一步的标准化和完善。
最后是研发资源分配不均,药企布局积极性相对较低。新药研发投入的多少往往与癌种的患者数量、疾病负担、治疗难度以及市场潜力等因素密切相关,四大癌症中,乳腺癌新药研发投入占60%,而子宫癌和宫颈癌(非疫苗领域)则相对落后。
未来趋势展望
科技发展与诊断技术为药物研究和创新提供了先进技术手段,高效研发平台及全新靶点,加速了药物研发进程并提高了成功率,预示着更多突破性治疗方法即将到来。展望未来,以下趋势值得关注。
ADC药物的全面渗透。ADC技术通过优化抗体、连接子和毒素的组合,未来很有希望在四大癌症中实现突破。
双抗与多特异性抗体崛起。这类抗体可以同时靶向肿瘤细胞和免疫细胞,或阻断多个信号通路,在克服耐药性上具有显著潜力。这意味着即使在肿瘤对单一疗法产生抵抗力的情况下,多特异性抗体也可能提供有效的治疗选择。
表观遗传与细胞疗法突破。业界正在探索组蛋白修饰剂、mRNA疫苗联合免疫疗法等新兴治疗方法,以期改变肿瘤的生长环境,恢复免疫系统对肿瘤的攻击能力。目前,CAR-T和TIL疗法在HPV相关宫颈癌中已显示初步疗效。
真实世界数据与人工智能的结合加速药物研发进程。通过分析电子健康记录、影像组学等大量真实世界数据,AI可以帮助研究人员更快识别耐药模式并预测药物响应,降低临床试验的成本和时间。
全球健康倡议正在推动公平性的提升。世界卫生组织“消除宫颈癌”战略的实施加速了HPV疫苗的普及,也推动了低价PD-1抑制剂在低收入国家的可及性。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






