多款新药勇闯心衰适应症
发布时间:2024-11-13 14:45:48作者:石军 综合编译来源:医药经济报
近日,BioCardia公司宣布,完成其核心产品CardiAMP的Ⅲ期临床研究(CardiAMP HF)最后一次随访,欲寻求FDA上市批准。此为首款利用患者自身细胞治疗心力衰竭(HF)的综合疗法。
随着HF患者群体的规模不断扩大,近期拜耳肾病药物Kerendia、诺和诺德减重药物Wegovy等也在努力跨界,试图分羹。
拜耳:拓适应症释潜力
按关键作用机制划分,目前上市销售的HF药物包括酶抑制剂、受体拮抗剂、转运蛋白抑制剂、酶激活剂、离子通道阻断剂、受体激动剂、离子通道激活剂、生物因子激活剂以及肽激活剂等。
根据市场调研机构Emergen Research公司发布的最新报告,2022年全球HF治疗药物销售额大约为122亿美元,预计在2023-2032年这一预测期内,复合年增长率(CAGR)为5.9%,届时市场规模将达到216.3亿美元。
3年前,拜耳的非甾体类盐皮质激素受体拮抗剂(MRA)Kerendia获批治疗与2型糖尿病相关的慢性肾脏病(CKD),但实际上,其大部分市场潜力在于它具有治疗HF的能力。
Kerendia自上市销售以来,销售额不断扩大,今年上半年达到2亿欧元(约合2.21亿美元),同比增长了70%。但要实现公司定下的30亿美元的年销售额,拿下HF适应症是需落下的关键一子。
近期,拜耳透露,Kerendia的Ⅲ期FINEARTS-HF试验数据积极。结果显示,与安慰剂相比,Kerendia让射血分数轻度降低的心衰(HFmrEF)患者或射血分数保留的心衰(HFpEF)患者发生心血管死亡风险以及首次和复发性HF事件降低了16%。
在一项对左心室射血分数(LVEF)超过40%的HF患者进行研究的Ⅲ期试验中,Kerendia是首款达到主要复合心血管终点的MRA。拜耳计划在适当的时候提交Kerendia用于LVEF超过40%的HF患者的上市许可申请。
在有6001名患者参与的试验中(这些患者也在接受标准治疗),Kerendia组和安慰剂组之间存在几个可比的指标:Kerendia组的严重不良事件发生率为39%,对照组为41%。在非因死亡而停止治疗的患者比例,Kerendia组为20.4%,安慰剂组为20.6%。
虽然高钾血症(钾水平升高)在Kerendia组中更为普遍,为10%对4%,但它仅导致0.5%的受试者住院。安慰剂组的这一比例为0.2%。
主要终点结果在所有预先设定的亚组患者中都是一致的。尤其值得注意的是,初始使用钠-葡萄糖协同转运蛋白-2(SGLT-2)抑制剂的患者与未使用这种抑制剂的患者都取得了相同的主要终点结果。
在另外一项关键的亚组分析中,Kerendia对于射血分数大于和小于60%的患者显示出了同样积极的结果。
诺和诺德:减肥药力战HF
GLP-1药物也想入局HF,诺和诺德Wegovy(司美格鲁肽)便是其中一员。8月底,诺和诺德表示,司美格鲁肽可以将心血管(CV)死亡或HF事件恶化的合并风险降低31%,这是基于使用司美格鲁肽的患者上述事件发生率为5.4%,而安慰剂组患者发生率为7.5%的数据。
根据对诺和诺德开展的四项试验所做的汇总分析,司美格鲁肽还使HF恶化的风险降低41%。诺和诺德所做的事后数据分析发表在近期《柳叶刀》杂志上,对总计3743名有HFpEF病史、使用两种司美格鲁肽剂量的患者的HF结果进行了研究。
具体来看,此为针对4项随机、安慰剂对照试验(SELECT、FLOW、STEP-HFpEF和STEP-HFpEF DM)进行的事后汇总分析,以评估每周一次皮下注射Wegovy(除了FLOW试验使用1.0毫克剂量外,其余皆使用2.4毫克剂量)对患者发生CF事件的影响。结果显示,在HFpEF患者中,Wegovy减少患者发生“心血管死亡或心力衰竭恶化事件复合终点”的风险减少了31%。
Wegovy先在欧洲市场取得进展,9月中旬,欧洲药品管理局(EMA)支持Wegovy用于缓解肥胖患者的CF。
实际上,Wegovy近来在扩展心血管疾病适应症方面屡有进展。10月28日,Wegovy在美国获批了一项新适应症:用于辅助治疗超重或肥胖的心血管疾病(CVD)成人患者,降低其主要不良心血管事件(MACE)的风险,包括心血管死亡、非致命性心脏病发作(心肌梗死)或非致命性中风。
尽管如此,诺和诺德仍然面临压力,因为其主要竞争对手礼来最近在一项后期试验中表明,与安慰剂相比,其GLP-1/GIP治疗药物替尔泊肽可以将发生不良HF结果的风险降低38%。此前,礼来已经表示,计划从今年晚些时候向FDA和其他监管机构提交试验结果。
Mesoblast公司:细胞疗法添光彩
值得注意的是,除GLP-1这一大热明星布局HF外,近年来热度颇高的细胞疗法也在该领域探索。今年年初,澳大利亚细胞疗法生物技术公司Mesoblast透露,根据它从美国FDA收到的反馈信息,公司用来治疗心衰晚期的细胞疗法有可能获得加速批准申请的资格。
当时,Mesoblast公司和FDA举行了一次B类会议,讨论了针对同种异体疗法Revascor 拟采取的下一步行动。FDA此前已对Revascor给予再生医学先进疗法(RMAT)和孤儿药资格认定,拟用于已经植入左心室辅助装置(LVAD)、射血分数降低的终末期缺血性HF患者的治疗。目前,尚未有经过FDA批准的细胞疗法用于HF治疗。
在为Revascor寻求批准时,Mesoblast公司提到了一项安慰剂对照研究,该研究对即用型Revascor用于70名射血分数降低的终末期HF患者进行了评估。公司报告称,植入细胞的患者体内炎症性细胞因子IL-6的水平降低。
单次给药Revascor也使得63%的试验参与者暂时脱离LVAD的支持,而对照组这一比例为36%。在接受Revascor治疗的患者中,4.9%的患者在第2~12个月死亡,而对照组为26.9%。
LVAD是进展为终末期HF患者的标准治疗方法,美国每年大约有10万个病例。虽然LVAD有效,但可能会出现感染和出血等并发症。
链接>>>
各类作用机制勤探路
心力衰竭(HF)是一种由心脏结构或功能缺陷引起的临床综合征,导致心室充盈或射血功能受损,从而降低患者的运动耐受性并增加死亡风险。该病主要表现包括呼吸困难、疲劳及运动能力下降,通常伴有液体潴留,导致肺和内脏充血及外周水肿。
该病治疗需要多管齐下,包括对患者进行教育,根据患者个人情况选择改善心脏收缩能力的最佳治疗方案,以及预防病情恶化。
近年来,HF和射血分数降低的患者生存率得到提高,新型疗法被证明可以改善HF患者的治疗结果。在HF药物市场上,一大趋势是钠-葡萄糖协同转运蛋白-2(SGLT-2)抑制剂的采用率越来越高。根据美国心脏协会和美国心脏病学会在2022年4月发布的指南,SGLT-2抑制剂已被引入治疗清单,此前,该类药物多用于治疗糖尿病。
目前在HF治疗市场上,主要的SGLT-2抑制剂有礼来和勃林格殷格翰的Jardiance,阿斯利康和百时美施贵宝(BMS)的Farxiga,以及Lexicon公司的Inpefa等。
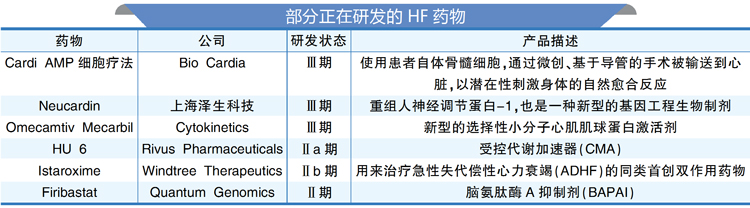
根据市场调研机构DelveInsight公司提供的数据,目前有超过75家药企正在开发HF药物,在研药物超过90款,机制各异。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






