T细胞接合剂迭代进行时
发布时间:2024-09-25 13:52:42作者:王迪 编译来源:医药经济报
近期,T细胞接合剂(TCE)赛道活跃。9月,一家名为Candid Therapeutics的TCE疗法企业获得3.7亿美元A轮融资,用于治疗自身免疫疾病,创下今年欧美生命科学领域金额最大单轮融资记录。Candid公司的CEO是华人学者Ken Song,其此前创立的核药公司RayzeBio以41亿美元卖给百时美施贵宝。此外,8月底,欧盟批准再生元开发的TCE产品Ordspono(odronextamab)用来治疗两种血癌。在获得欧盟批准用于复发或难治性滤泡性淋巴瘤(FL)和复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)之后,Ordspono成为再生元第一款获得批准的双特异性抗体。这一批准针对的是那些已经接受过两种或以上系统治疗的患者。
血液治疗新利器
近年来,利用人体细胞免疫反应治疗血液系统恶性肿瘤成为一种颇具前景的方法。基于单克隆抗体(mAb)的靶向疗法的出现显著改善了该类患者的预后。但随着时间的推移,癌细胞可能通过多种机制对单克隆抗体产生耐药性。此外,这种药物无法激活细胞毒性T细胞的反应,限制了在诱导免疫反应方面的潜力。
为了解决这些问题,新型双特异性抗体(BsAb)应运而生。这种药物可与多种抗原结合,将免疫活性靶向作用于目标细胞,减少严重不良事件的发生,一定程度上防止耐药性。
BsAb模式也在不断创新,最终产生了TCE。TCE可同时靶向作用于某些种类的肿瘤相关抗原(TAA)和T细胞上存在的CD3分子,使T细胞的细胞毒性活性对抗癌细胞,最终促使肿瘤细胞的裂解。TCE主要分为三种:免疫球蛋白G(IgG)样TCE、可结晶片段(Fv)类TCE和组合类TCE。
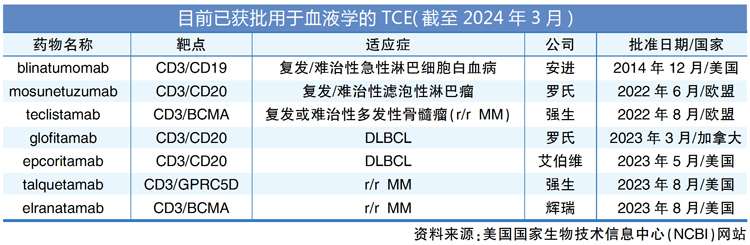
目前,双特异性T细胞接合剂(BiTE)分子被认为是TCE药物中前景最好的一种。截至2024年3月,市场上有7种获批用于临床治疗的TCE疗法,都被用来治疗淋巴细胞增生性疾病。
Ordspono:欧盟抛出橄榄枝
Ordspono的批准主要基于Ⅰ/Ⅱ期临床试验的积极数据。在ELM-2研究中,FL患者的总体缓解率(ORR)为80%,其中73%达到完全缓解(CR)。对达到CR的患者来说,缓解持续时间(DoR)的中位数为25个月。
在同一项研究中,没有接受过CAR-T疗法的DLBCL患者的ORR为52%,其中31%达到CR,中位DoR为18个月。
尽管得出了这些研究结果,但今年3月,FDA向再生元发出了两封完整回应函,拒绝了该公司提交的加速批准该药的申请,彼时Ordspono的验证性试验尚未进行。
FDA做出拒绝批准决定之际,该机构正在努力解决加速审批政策的定位问题。最近发表在《美国医学会杂志》上的研究表明,80%通过这种途径批准的药物在五年之后并未能显示出生存益处。因此,业内正在讨论这一机制的有效性。
Ordspono上市后有不少竞争对手,包括艾伯维和Genmab开发的双特异性抗体Epkinly(Epcoritamab),罗氏也有两款TCE在市场上销售。
上述获批药物都作为三线治疗用途。在临床试验中,包括再生元在内的每家公司都将TCE与其他药物联用,力图将药物推进至早期治疗线。
Imdelltra:加速审批有争议
今年5月,FDA加速批准安进的TCE产品Imdelltra上市,被认为是用来治疗小细胞肺癌(SCLC)的一大突破,也是众多潜在性新药中第一款DLL3靶向疗法。但是,Imdelltra的加速批准伴随着“大量”不良事件(AE)报告不足及其他问题。
FDA认为,在支持Imdelltra获批用于先前治疗过的广泛期小细胞肺癌(ES-SCLC)的Ⅱ期DeLLphi-301试验中,来自该研究一半患者的近400例AE没有在该药的最初申请中予以报告。
为了回应FDA发现的相关问题,安进开展了全面审查。相关信息被纳入Imdelltra标签。具体来看,对DeLLphi-301试验所做的原始安全性评估包括参与该研究的220名患者,分成3组,接受了至少一剂Imdelltra。一名患者可能会出现多起AE。FDA的安全性审查考虑了来自DeLLphi-301和有187名患者参与的Ⅰ期DeLLphi-300试验的最新90天安全性数据集。
大多数漏报的AE是细胞因子释放综合征(CRS)和神经毒性,属于较轻的1级或2级。在393例新发现的AE中,有28例为3级事件,3例为严重事件。至少有2例死亡与肿瘤进展有关。
在审查了90天的安全性数据和未报告的AE之后,FDA得出较积极结论,安进针对所有DeLLphi-301试验基地开展的原始数据核对(SDV)似乎可以支持它所提交的申请。
默沙东:欲分TCE一杯羹
想进入这一赛道的大药企还有默沙东。近期,默沙东宣布与同润生物(Curon Biopharmaceutical)达成协议,将预付资金7亿美元,获得后者开发的CD3xCD19双特异性抗体CN201的全球权利。除了向同润生物支付前期费用外,默沙东还同意支付高达6亿美元、与开发和监管批准相关的里程碑费用。
同润生物今年早些时候公布了CN201用于非霍奇金淋巴瘤(NHL)和急性淋巴细胞白血病(ALL)的积极数据。同润生物报告称,此前接受过多种其他疗法之后疾病发生进展的患者实现完全缓解。
在围绕CN201开展的NHL和ALL试验中,CRS分别发生在7%和31%的患者中间。大多数事件发生在第一剂用药之后。在ALL试验中,有一名患者出现了3级反应,但是其余CRS都比较轻微。默沙东计划,继续对CN201在B细胞恶性肿瘤中的作用进行研究。
8月6日,默沙东与第一三共宣布,将共同开发及商业化MK-6070。默沙东将获得预付款1.7亿美元。MK-6070是一款三特异性TCE,结合T细胞上的CD3和肿瘤细胞上的DLL3,第三个结构域结合白蛋白以延长半衰期,目前正处于Ⅰ/Ⅱ期试验阶段。
DLL3在70%以上的SCLC中得到表达。此外,默沙东和第一三共之间的原始交易包括ifinatamab deruxtecan,此为一种B7-H3靶向抗体药物偶联物(ADC),最近进入SCLC的Ⅲ期试验阶段。两家公司计划将该款ADC和三特异性药物联用,治疗SCLC患者。
挑战与机遇并重
市场调研机构GlobalData公司预测,到2030年,BiTE将创造206亿美元的销售额,比2023年增长1320%。分析人士还预测,到2030年,强生的产品Tecvayli(Teclistamab)和Talvey(Talquetamab)将成为两款最畅销的BiTE,占该类药物总销售额的40%。
近年来,基于BsAb的疗法彻底改变了血液系统恶性肿瘤的治疗。但由于肿瘤免疫逃避的机制,比如靶抗原的丧失或者免疫检查点上调引起的T细胞失能和耗竭,很多患者无法长期从基于TCE的免疫治疗中获益。
目前正在开展的研究将TCE疗法与其他治疗药物如标准化疗药物或免疫检查点抑制剂(ICI)结合,以克服这些问题。改善TCE的分子结构可能会增强它们的亲和力、灵活性和半衰期。此外,Imdelltra作为首款用于小细胞肺癌的TCE,也为其他同类产品拓展发展空间、在血液系统以外的实体瘤治疗领域发挥作用提供了借鉴和参考。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






