善用工具、内修思维,稽查员培训进阶
发布时间:2024-09-18 17:30:51作者:彭晓雯来源:医药经济报
工欲善其事必先利其器。要成为独当一面、火眼金睛的新药临床试验中心稽查员,除了要精通《药物临床试验管理规范》(GCP)、储备医药学知识、深入理解质量管理外,还应借助稽查工具增加大脑内存、借助计算机系统已有数据做功课,并提升审辩式思维(也称为批判性思维)做好稽查。
9月5日,本报研发版刊发《临床研究GCP稽查员积微成著提升职业素养》一文,初论稽查员如何在文山瀚海“修炼内功”的上半部分。本篇,作者将探讨稽查员培训的下半部分。
巧用计算机系统数据报表
临床试验电子数据采集系统(EDC)、临床试验管理系统(CTMS)、临床试验主文件系统(TMF)有大量已经产生的临床试验数据和文件,稽查前,稽查员可在这些系统查阅或导出数据报表进行事先阅读分析,现场稽查时就更能有的放矢。
稽查员可从EDC导出受试者电子病历报告表(eCRF),到现场后与其原始病历进行核对,还可从EDC导出不良事件(AE)、合并用药、试验用药剂量、终点数据等字段的综合数据列表。稽查员通过这些报表,不去现场也可能发现问题,到现场后更能快速聚焦风险可疑问题。
CTMS的数据则方便稽查员了解项目进展,查看病人入组数量、历次监查时间、监查报告、既往药物不良事件和方案偏离的情况等,从而预判风险和问题领域,和EDC数据报表一起,帮稽查员缩小现场需仔细查看的文件范围。
稽查员若能事先查阅电子化TMF系统,就犹如延长了现场稽查的天数。按GCP指南和行规,已产生的研究中心文档应在随后大约30~90天被收回归档到TMF。稽查员坐在电脑前远程查看TMF文件时,再与EDC、CTMS数据结合起来考虑,可在大脑里构建该试验发生的过程,显著提升现场稽查效率。
稽查准备笔记必不可少
由于临床研究的文件较多,称职又认真的GCP稽查员除了使用上述系统工具,还会提前做好稽查笔记,记录自己在阅读方案、试验文件和审阅EDC等数据时已发现的重点、疑点。
稽查员的稽查清单工具可以按“研究者文件夹”“知情同意过程”“研究人员资质和授权”“单个受试者参与试验的过程”“AE和合并用药”“试验药物管理”等模块整理,可以做成Excel组表,也可用OneNote记录汇总。
准备稽查阶段从方案、EDC系统,监查报告等读到的重点信息和疑点,都可以填写至对应模块Excel表或OneNote笔记中。到了研究中心,就可根据清单式稽查笔记,头脑“接力”继续查看实际试验中产生的文件记录。正如《清单革命》所言:“建立核对清单,是保证持续、正确、安全地把事情做好的最好途径”。
笔者不止一次地见证到新手稽查员通过学习练习使用EDC等系统数据,并学习如何做稽查笔记清单后,就对稽查不再有畏难情绪,而是变得豁然开朗。
重视访谈技巧批判思考
稽查员除了默默看文件资料,按GCP规则、方案等进行逻辑对比,形成初步判断,还要通过访谈研究中心的医师、药师、临床研究协调员(CRC)和监查员(CRA)等进一步查清操作细节。这就是稽查员的访谈工作。
稽查的访谈,一般针对从文件审阅发现的问题,通过对话去梳理某事发生的过程,来确认试验操作是否存在问题。访谈可以问开放式的5W1H(When,Where,Who,Why,Which,How)问题。例如询问:作为盲态药师,你怎样发放试验药物?也可用闭合式的问“是或否”来确认事实。例如询问:请问你被培训了新版的《试验室手册》了吗?
稽查员需摒弃“想当然”或“轻信他人”的思维习惯,对证据事实有一种孜孜不倦的求索精神。将访谈人所讲,再结合所见的文件记录,以及GCP和试验既定规则,综合判断试验操作是否合规。
审辩式思考能力是稽查员的底层能力,可通过经常自我辩论、阅读思考力书籍(例如《学会提问》和《金字塔原理-思考、表达和解决问题的逻辑》)、与资深同行讨论稽查复杂案例进行提升。
厘清问题方可整改预防
稽查结束后,稽查员需以报告形式来简明清晰呈现试验中的问题。清晰的写作能力,反映着清晰的思考能力。
遗憾的是,目前行业里,叙述模糊的稽查报告也常常见到。这些报告通常是罗列一堆事实,然而哪怕懂临床试验的读者也不知稽查员发现的问题到底是什么。
稽查员提升报告撰写能力,可以先从写清楚一个不合规问题(Finding)开始,先练习如何一语中的提炼问题,也就是写清楚“Leading statement”。
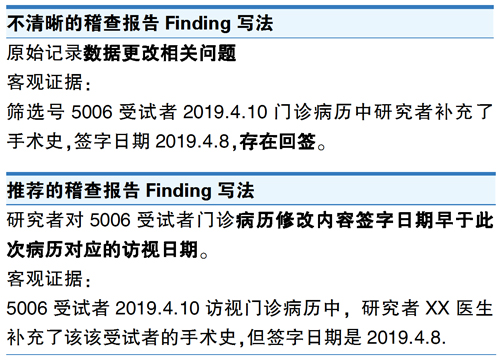
其次,稽查员一定要明确每个Finding是否站得住脚,要清晰指出该问题违反了GCP或方案或标准操作流程的哪些规定。
第三,需要注意将相似的问题进行合并同类项的处理。例如“查阅原始数据,发现有合并用药或不良事件未完整录入EDC,另有几位受试者用药信息录入错误”。
最后,稽查员还要能够审阅不合规问题对应的纠正预防措施(CAPA),并提供反馈和建议。如果稽查员Finding问题写不清晰,做CAPA时,有时会倒逼稽查的各方去发现真正的Finding真相。
例如:某稽查员在报告里写了这样的Finding:“研究启动2月后,监查员发现研究者在所有化验单上均未签署CS/NCS和日期”(CS:有临床意义,NCS:没有临床意义)。这就存在多种事实可能性,第一种可能性是研究者在病历上对试验室检查异常值进行了CS和NCS的评估,EDC数据库里也有相应评估,只是在化验单上没有签署CS/NCS和日期;其他的可能性是:研究者在化验单、病历均没有做CS/NCS评估。根据不同的Finding情形,需要的整改CAPA或许不同。
稽查报告撰写和审阅CAPA,和提高申辩思维能力一样,需要高强度长时间的刻意练习,最好有高手指导。
固本强基全面成长
做好临床试验的稽查绝非易事,成为合格稽查员需要对临床试验的过程、要求、法规和方案非常熟悉,而且要在事前做详尽的准备功课,并在现场稽查时全神贯注,结合现场文件、自己的笔记和头脑中已经熟悉内化的规则快速反应和判断。
初入行的稽查员可以从一些简单模块的稽查开始逐步精进,例如研究者文件夹、知情同意书、试验药品的储存、分发、使用和回收,等储备了足够的经验和医药学知识,也熟悉稽查的疾病后,就可以独自稽查受试者入排标准、疗效指标、不良事件等关键数据对应的文件和流程。
如果练习稽查时,有优秀导师的带领和反馈,会比独立努力更能加速成长。如果自身自学能力、思维能力的底子好,也可以循序渐进,使稽查技术日臻完美。
★★★ 小结 ★★★
综上,临床研究法规要求稽查员应经过培训,具有稽查经验,能有效履行稽查职责。然而合格稽查员到底需要何种资质和能力,业内尚无达成一致的系统性培训和考核标准。
笔者将自己培训稽查员的方法和实践中的问题和感悟付诸笔端,希望能抛砖引玉,激发起更多相关人士的思考和讨论,更好确保新药临床试验的数据质量,最终为民众的科学安全用药贡献绵薄之力。
(作者彭晓雯,现任康德弘翼医学临床研究公司质量保证部高级主任。本文也感谢武田制药李丹丹的贡献。)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






