AD新药在欧被拒?一息尚存
发布时间:2024-08-07 18:56:16作者:樊凤辉来源:医药经济报
阿尔茨海默病(AD)新药可及之路漫漫。近日,欧洲药品管理局(EMA)宣布拒绝推荐卫材/百健的AD药物Leqembi上市。此前,该药已获美国等国监管机构批准。本次卫材提供给EMA审评的信息与FDA批准Leqembi上市所依赖的临床试验相同,即入组了1795例脑中有淀粉样斑块的患者的18个月的多中心双盲的Clarity ADⅢ期临床研究,在该项临床研究中有的患者接受Leqembi治疗,有的患者则接受安慰剂对照。
除了美国,Leqembi也已在日本、中国、韩国和以色列获得批准上市,用于治疗由AD引起的轻度认知障碍(MCI)和轻度阿尔茨海默病痴呆。
疗效不足以抵消风险?
EMA拒绝推荐Leqembi上市的主要原因是什么?Clarity AD临床研究显示,在接受Leqembi治疗18个月后,患者的临床痴呆评分量表(CDR-SB)评分增加了1.21,而接受安慰剂的患者则增加了1.66。虽然接受Leqembi治疗的患者的CDR-SB评分低于接受安慰剂的患者,两组之间0.45的差异很小。
另外,Leqembi最重要的安全性问题是与淀粉样蛋白相关的影像学异常(ARIA)频繁发生。此为一种在脑部影像中可见的副作用,涉及大脑肿胀和潜在出血。虽然主要研究中的大多数ARIA病例并不严重且无症状,但一些患者出现了严重事件,包括需要住院的大出血。
CHMP还担心在拥有某种形式的载脂蛋白E(ApoE4)基因的患者中,ARIA的风险更为明显,且拥有两份ApoE4基因患者的ARIA风险最高。由于携带ApoE4等位基因的个体患AD的风险显著增加,他们可能成为Leqembi治疗的适应症患者。
在考虑了包括神经学家和患病者在内的神经病学科学咨询小组的意见后,CHMP认为Leqembi治疗的益处不足以弥补与Leqembi相关的风险,因此拒绝推荐Leqembi在欧盟上市。但Leqembi在欧上市之路即将止步于此吗?
在欧上市生机尚存
EMA于7月25日发布了不支持推荐Leqembi上市的意见。不过,Leqembi在欧洲递交上市申请的公司卫材GmbH可在收到意见的15天内要求重新审查。卫材也反应迅速,于7月26日宣布,将寻求重新审查CHMP的意见。
7月31日,卫材官网便公布了在近日举行的2024年阿尔茨海默病协会国际大会(AAIC)上展示的关于Clarity AD临床研究成果,涵盖前18个月核心阶段治疗及后续开放标签阶段共计3年的治疗时间。
该临床试验的主要临床终点为认知和功能量表CDR-SB测量,数值范围为0~18,数值越高表示AD疾病越严重。由于入组的是轻微症状的AD患者,Leqembi治疗组和安慰剂对照组入组患者的CDR-SB值相当且较低,均约为3.2左右。
无论是Leqembi治疗组和安慰剂对照组,在Clarity AD临床试验过程中AD疾病仍会有进展,只是Leqembi治疗组的AD疾病相对于安慰剂组进展缓慢,导致Leqembi治疗组的CDR-SB值相对于安慰剂对照组下降缓慢。
在18个月核心阶段治疗完成时,Leqembi治疗组与安慰剂对照组相比CDR-SB值的下降减缓了0.45,而包括18个月的核心阶段的三年使用Leqembi治疗完成时,与相当于或类似于真实世界数据的ADNI1组的患者相比,Leqembi治疗导致患者的CDR-SB值的下降减缓了0.95。
卫材认为,与18个月时的CDR-SB值下降减缓0.45效果相比,三年Leqembi持续治疗导致的CDR-SB值下降减缓0.95表明Leqembi的三年治疗相较于18个月的治疗的效果更显著,这也表明Leqembi对早期AD患者持续有临床和个人意义的益处。
新秀疗效看似更优
那么,卫材的Leqembi减缓CDR-SB数据下降的真实意义有多大?笔者认为,可先从美国FDA最近批准的另一款AD治疗用抗Aβ单抗礼来的Kisunla说起。
FDA批准礼来的Kisunla是基于主要临床终点为iADRS、次级临床终点包括CDR-SB量表评分的TRAILBLAZER-ALZ 2临床试验。对于CDR-SB量表评分这个次要临床终点,TRAILBLAZER-ALZ 2临床试验中对于可以与Leqembi的Clarity AD相比较的tau高/中/低患者,Kisunla治疗组治疗76周时的CDR-SB量表评分变化为1.72,安慰剂对照组为2.42,礼来采用了(2.42-1.72)/2.42=28.9%,并将此值称为Kisunla治疗带来的AD疾病进展减缓率。
按此定义,Leqembi治疗18个月的-0.45相当于Leqembi治疗带来的AD疾病进展减缓率为0.45/1.66=27.1%,Leqembi治疗三年的-0.95相当于Leqemb治疗带来的AD疾病进展减缓率为0.95/4.04=23.5%。显然从疗效上讲,Leqembi不占优势。
另外,需指出的是,考虑CDR-SB量表评分范围为0~18,无论是Kisunla的2.42-1.72=0.7还是Leqembi的0.45或0.95,相对于这个范围都是一个较小的值。
卫材7月31日官网的信息认为,在记忆、社区事务和家庭/爱好这几个CDR评分领域中,从0.5~1的变化代表了从轻微损伤到失去独立性的区别。但2022年有综述性文章发表认为,CDR-SB评分增加1~2分才被认为是具有临床意义的AD病情发展的变化。因此,有必要继续关注EMA如何处理卫材GmbH就Leqembi上市申请的重新审查请求。
有望打消安全性疑虑
安全性方面,卫材7月31日官网信息显示,在连续三年使用Leqembi治疗期间,没有观察到新的安全性发现。敏感性分析显示,ARIA 对认知或功能没有影响。从这些结果来看,ARIA与加速的AD疾病长期进展无关。
另外,FDA批准的Leqembi说明书要求,在第1次,第5次,第7次,第14次输注Leqembi前进行一次磁共振检查,目的也正是为及时发现ARIA现象从而及时采取相应措施而避免严重不良反应的发生。因此,EMA对Leqembi的安全性担忧的依据似乎不够充分。
需指出的是,卫材的Leqembi三年治疗数据突出了-0.95这个数据比18个月的-0.45这个数据更为显著。
卫材7月31日官网信息还包括如下关于Leqembi的疗效信息:
一是超过50%的早期AD患者在接受三年Leqembi治疗后继续显示出改善。
二是斑块清除后,Leqembi在治疗过程中继续对生物标志物产生积极影响。
三是Leqembi减缓了tau在大脑区域的扩散。
综上所述,这些信息将有助于说服EMA认可Leqembi的有效性及安全性,也进一步构成对于在达到治疗目的后可以停药的Kisunla的重大挑战。
取长补短共促研发
诚然,Leqembi与Kisunla都属于抗Aβ单抗,但二者靶点不同:Kisunla的靶点是最终的不可溶的淀粉样斑块状态的Aβ,而Leqembi的靶点是不可溶的淀粉样斑块的前体即原纤维状态的Aβ。卫材认为,Leqembi具有清除淀粉样斑块和其前体即原纤维的双重功能机制。原纤维在AD患者大脑中早期积累,导致神经细胞功能丧失、神经过程异常、炎症和记忆丧失。在非临床研究中,针对原纤维的抗体阻止了由原纤维介导的神经功能障碍和记忆丧失。Leqembi以最高的亲和力优先结合有毒的原纤维。在迅速清除斑块和现有的原纤维后,可继续清除不断发展并损害神经元的原纤维。
由此来看,Leqembi在欧洲的情况还可能会出现转机。如最终欧洲不支持Leqembi上市,会对Leqembi及Kisunla在其他国家/地区的市场造成一定影响。
但如果Leqembi及Kisunla在其他获批国家的应用能够进一步展示良好的疗效和安全性,也有助于Leqembi在欧盟的获批上市。
无论如何,目前Leqembi与Kisunla的临床数据显著提高了人们对于靶向Aβ靶点及靶向tau靶点的创新药物的认知,有利于在这两款药物在临床使用过程中采取预防不良反应产生的应对措施。
相关
7月EMA审批观势
7月底,在EMA的人用药委员会(CHMP)给予Leqembi负面意见的同时,该机构对14种药物的上市申请授予积极意见,其中包含7款原研药。
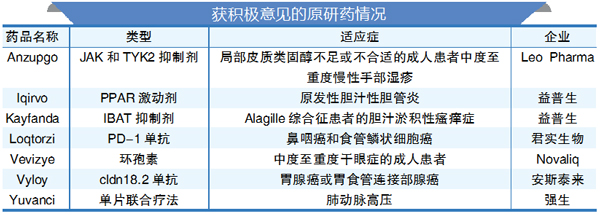
此外,还有6款生物类似药获CHMP积极评价:3款为强生乌司奴单抗生物类似药,罗氏利妥昔单抗和曲妥珠单抗生物类似药以及诺华的雷珠单抗生物类似药。还有1款辉瑞的阿西替尼仿制药。(吕书农 编译)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






