PBC在研明星药蓄势待发
发布时间:2024-07-01 14:43:31作者:石军 编译来源:医药经济报
有些新药研发之初,在拟定适应症赛道屡次折戟,“无奈”转换赛道焕发生机,甚至摇身一变成为畅销单品。在原发性胆汁性胆管炎(PBC)领域,便有药物曾欲征战代谢功能障碍相关脂肪性肝炎(MASH)沙场,却在PBC赛道发光。
近日,益普生和Genfit公司开发的Iqirvo(elafibranor)被FDA加速批准用于治疗PBC,成为第三款PBC获批药物。此外,吉利德的在研PBC新药也向FDA递交了上市申请,今年8月见分晓。
现有治疗选择少
PBC是一种由肝脏胆管渐进性破坏引起的慢性进行性自身免疫肝病,会导致胆汁和毒素积聚,使肝脏出现炎症和纤维化,发病机制尚不明确。该病常见症状是感到疲倦和皮肤发痒,许多患者在首次确诊时无症状,女性患PBC的概率是男性的9倍。
目前尚无治愈PBC的方法,全球获批治疗药物仅3款。1997年,熊去氧胆酸(Ursodiol/UDCA)成为美国FDA批准的第一种用于PBC的药物。UDCA通过稀释胆汁酸池,减少胆汁淤积。作为一线治疗药物,它改善了患者的预后。然而,大约40%的PBC患者对UDCA应答有限,且有5%~10%的患者服药后出现体重增加、脱发或胃肠道副作用而不能耐受。
为更准确地评估患者的预后,优化临床试验设计,提高药物疗效评估的准确性,业界开发了包括GLOBE评分在内的新预后评分系统。GLOBE评分可预测PBC患者的长期预后。
2016年,奥贝胆酸(Ocaliva,OCA)成为FDA批准的第二只PBC治疗药物,其获批主要基于患者体内碱性磷酸酶(ALP)水平得到改善,此为评估肝脏损伤程度的关键生物标志物。
OCA是一只二线治疗药物,作为UDCA的辅助剂,或者对UDCA无法耐受的患者的单一疗法。在Ⅲ期POISE试验(N=216)中,46%~47%接受OCA治疗的患者达到主要终点,而对照组患者的这一比例为10%。
根据市场调研机构Next Move Strategy Consulting公司提供的数据,2023年,全球PBC药物销售额达到8.71亿美元,预计2024-2030年,销售额将以年复合年增长率(CAGR)9.8%的速度增长,届时销售额将达到16.80亿美元。
新兵发展有短板
Iqirvo是一只“First-in-Class”过氧化物酶体增殖物激活受体(PPAR)激动剂,曾被宣称是治疗MASH的潜在性重磅炸弹药物,但彼时试验数据不佳。2021年,益普生以4.8亿欧元(约合5.15亿美元)的价格从Genfit公司获得该药治疗PBC的许可。
值得注意的是,Iqirvo并非首个在MASH领域碰壁的PBC药物。OCA在获批治疗PBC后,欲扩展适应症至MASH,并迅速推进至临床Ⅲ期试验,却因易引发严重瘙痒症状等一系列风险铩羽而归。
FDA基于Ⅲ期ELATIVE试验数据加速批准了Iqirvo用于PBC。数据显示,Iqirvo能显著降低ALP水平。根据ALP水平评估,Iqirvo治疗组的生化反应率为51%,而安慰剂组仅为4%。此外,Iqirvo组还达到了关键的次要终点,使15%的患者ALP水平正常化,而安慰剂组为0%。
不过,Iqirvo能否获得完全批准,还将取决于后续验证性试验,试验将确定Iqirvo是否能提高生存率,并防止腹部肿胀或胃肠道出血。
Iqirvo和OCA均被批准与UDCA联合用于PBC,或者作为单一疗法,用于那些无法使用UDCA的患者。也就是说,Iqirvo站上牌桌,直接与Intercept公司上市销售长达8年之久的OCA展开竞争。市场分析人士估计,到2027年,Iqirvo的销售额将达到1.93亿欧元(约合2.07亿美元),销售峰值达到4亿欧元(约合4.29亿美元)。
不过,患者使用Iqirvo后瘙痒症并未减轻,可能成为其竞争时的“阿喀琉斯之踵”。
在研明星蓄势待发
Iqirvo是首款获批用于PBC的PPAR激动剂,还有一些潜力新秀蓄势待发。近期,吉利德更新了肝病治疗药物seladelpar的Ⅲ期ENHANCE试验积极数据,为其不久后申请上市成功增添信心。
seladelpar同Iqirvo一样,均曾在MASH领域折戟。2019年6月,seladelpar治疗MASH的Ⅱb期临床试验未达主要终点,治疗组患者肝脏脂肪含量(LFC)的减少程度劣于安慰剂组。再加上该药有潜在的肝损伤风险而停止试验。
今年2月,当吉利德以43亿美元收购CymaBay Therapeutics公司时,seladelpar的Ⅲ期试验已可圈可点。吉利德将其Ⅲ期研究和早期试验中将参与者汇聚到了一起,生成了一个包含300多名PBC患者的数据集,在6月初举行的欧洲肝脏研究协会(EASL)大会上发表。在参与早期试验的使用seladelpar长达24个月的患者(N=99)中,70%的人达到了综合反应终点,该终点着眼于肝脏健康的多种标志物。在24个月时,42%的参与者ALP水平正常化。
吉利德还报告了受试者瘙痒症状得到持续改善。从接受治疗的12~24个月,患者瘙痒的平均减轻程度略有下降,在两次分析期间从3.8分降至3.1分。吉利德将这一影响看作seladelpar的一个关键优势。
另一项开放标签的ASSURE研究包括了174名患者,之前已经参与了seladelpar的另外一项研究,并且对UDCA应答欠佳。这些患者每天口服10mg seladelpar,几乎所有患者都是女性,也接受UDCA治疗。
最终,共有148名患者完成了为期12个月的治疗。中期研究数据显示,有70%的患者达到具有临床意义的综合反应终点。在所有接受seladelpar治疗的患者中,37%的患者ALP水平恢复正常。
有关肝损伤的其他生物标志物也出现下降。具体来说,与基线水平相比,总胆红素下降9%,γ-谷氨酰转移酶(GGT)下降36%,丙氨酸转氨酶(ALT)下降25%。
吉利德报告称,没有出现与治疗相关的不良事件,4.6%的患者因不良事件而停止用药。鉴于seladelpar的试验表现,有业内人士认为其有潜力成为“Best-in-Class”疗法。
2023年12月,seladelpar的批准申请被提交给FDA。FDA预计将在8月14日对seladelpar上市申请做出决定。
链接
市场呼唤更多新药
近年来,对PBC的分期、自然历史、预后和治疗等研究取得了重大进展。一个重要的变化是,2015年11月以来,国际上正式将原发性胆汁性肝硬化更名为原发性胆汁性胆管炎(PBC),缩写形式不变,主要是大多数患上这种疾病的人并没有肝硬化。
目前有一些药物正在被评估作为PBC的治疗选择,其中碱性磷酸酶(ALP)的改善是一个主要终点。大多数试验都记录了ALP水平的变化,尽管一些研究没有报告GLOBE评分,但ALP发生的变化可以转化为GLOBE评分的变化。
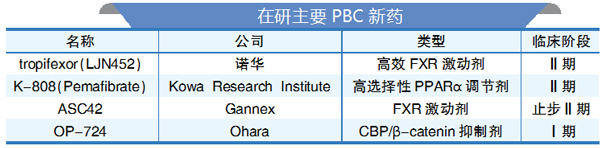
根据DelveInsight公司发布的最新报告,目前有28家以上的药企在开发PBC药物,在研药物超过28款。这些药物可以被划分为:过氧化物酶体增殖因子激活受体(PPAR)激动剂、NOX抑制剂、非胆汁酸FXR激动剂、FGF-19类似物、Budesonide和IBAT抑制剂。
此外,免疫调节剂、抗逆转录病毒疗法、抗氧化剂和间充质干细胞等其他药物也正在被评估作为PBC的治疗选择。不过,这些研究大多数仅限于小样本患者,仅报告ALP水平的下降。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






