IO+疗法理想能否照进现实
发布时间:2024-05-06 13:44:44作者:张琦来源:医药经济报
肿瘤免疫治疗(IO,Immuno-Oncology)是一种利用人体免疫系统攻击和杀死癌细胞的治疗方法。近年来,随着PD-1/PD-L1抑制剂、CAR-T疗法等大热,免疫疗法在肿瘤领域的应用得到飞速发展。科学家不仅在寻找更多的免疫检查点,也在尝试现有免疫药物与化疗、靶向药、抗体药物偶联物(ADC)等的联合使用。
这些探索的出发点是对两类药品作用机理的深刻理解,期待它们在共同作用下产生协同增效的结果。但理想与现实之间往往存在差距。
近期,阿斯利康宣布旗下PD-1抑制剂Imfinzi与PARP抑制剂Lynparza组合治疗,将子宫内膜癌患者缓解时间提高两倍以上;然而,默沙东Keytruda(K药)与实验性TIGIT单抗vibostolimab治疗转移性鳞状非小细胞肺癌(NSCLC)Ⅲ期试验、K药与Lynparza治疗转移性NSCLC患者Ⅱ期试验均以失败告终……IO+疗法,潜力空间到底有多大?
IO+化疗/ADC局势大好
IO疗法的原理是通过激活、增强或者调节患者自身的免疫系统,使其能够识别并清除体内的肿瘤细胞。
IO+化疗的联合,已被证明疗效显著。化疗药物杀伤或抑制肿瘤生长,免疫治疗通过激活本身免疫功能来杀伤肿瘤细胞,同时抵御化疗的毒副作用,二者作用叠加。目前免疫+化疗已经成为晚期非小细胞肺癌(NSCLC)患者的标准一线治疗,Keytruda(K药)+化疗组合已经获批用于NSCLC、三阴性乳腺癌(TNBC)、宫颈癌、胃癌、头颈癌和食管癌等癌症的一线治疗。
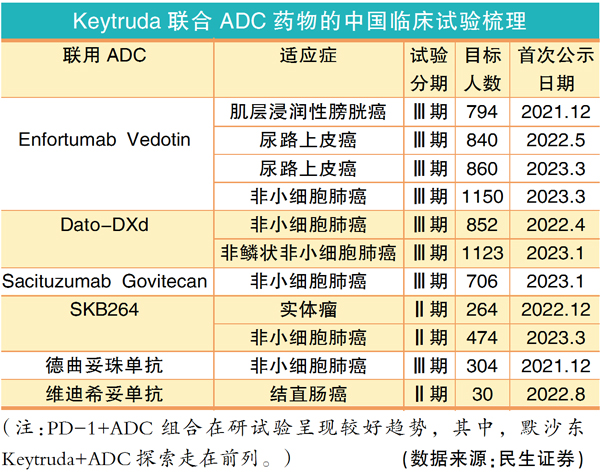
IO+ADC的联合是目前IO+疗法中试验最多的组合,也有相关组合已经获批。ADC被称为靶向递送毒性小分子的“生物导弹”,PD-1+ADC双剑合璧后,ADC中的激动剂能够触发固有免疫和获得性免疫,使大量T细胞浸润肿瘤,从而提高PD-1疗效。
PD-1+ADC的首次获批是在2023年4月,FDA加速批准了Seagen/安斯泰来研发的Padcev(Nectin-4)联合K药,可以用于不适合接受以顺铂为基础化疗的局部晚期或转移性尿路上皮癌患者的一线治疗。
PD-1+ADC组合的在研试验,也都显示出比较好的趋势。
如默沙东与阿斯利康合作的DS-1062(Trop2)与K药联用,一线治疗PD-L1阳性晚期/转移性NSCLC的Ⅲ期临床试验。该组合Ib期数据显示:缓解率(ORR)为37%,叠加铂类化疗治疗ORR为41%;作为一线疗法时疾病控制率(DCR)为100%。
吉利德的ADC药物Trodelvy与K药联用的试验目前已有6项正在进行中,包括2项Ⅲ期临床——治疗NSCLC的EVOKE-03、针对不可手术治疗的晚期或转移性三阴乳腺癌的ASCENT-04;4项Ⅱ期临床——针对NSCLC、TNBC、HR+/HER2-转移性乳腺癌、膀胱癌。
第一三共的Dato-DXd、科伦博泰的SKB264也都有多项相关试验在推进。
双免疫疗法效果不一
IO+IO也被称为“双免疫组合”,通过分别靶向两个不同的检查点,帮助药物杀伤肿瘤细胞。理论上,由于两种药物作用机制不同,且具有潜在的协同作用机制,可以强强联手,达成“1+1>2”的治疗效果。因此,几乎现有的每个免疫靶点都曾与PD-1抑制剂做过组合,包括CD137、OX40、Lag3、TIGIT、TIM3等。
然而,双免疫疗法在不同癌症的实际应用效果良莠不齐。至今,仅有CTLA-4和LAG3获批与PD-1联合治疗。
百时美施贵宝的Opdivo(O药)2023年更新的研发管线显示,此前布局的TIGIT单抗、IL-8单抗仍在推进研发,其余管线已经终止。
在双免组合的探索中,开启TIGIT+PD-1/PD-L1联用风向的罗氏经历相当曲折。彼时,罗氏旗下Tiragolumab作为全球首款TIGIT单抗,受业内瞩目。然而TIGIT单抗作为单药,在多项临床试验中疗效不佳。
转机发生在2020年,罗氏公布PD-L1抑制剂Tecentriq+Tiragolumab联用Ⅱ期临床CITYSCAPE研究数据,结果显示,该组合在治疗PD-L1阳性、局部晚期不可切除性或转移性NSCLC患者较单用Tecentriq相比,可以提高客观缓解率(ORR)和无进展生存期(PFS)。因此,美国FDA在2021年授予Tiragolumab突破性疗法认定,也掀起业内TIGIT+PD-1/PD-L1研究热潮。
然而,这一组合命运多舛,接连多项Ⅲ期试验未达主要终点:SKYSCRAPER-02研究“Tiragolumab+Tecentriq+化疗”用于广泛期小细胞肺癌(ES-SCLC)未达PFS终点;SKYSCRAPER-01研究“Tecentriq+Tiragolumab”用于NSCLC未达PFS终点……
不过,在2023年8月,“Tecentriq+Tiragolumab”一线治疗PD-L1高表达NSCLC的Ⅲ期SKYSCRAPER-01研究数据意外泄露,又让人看到了这一组合的生机:数据显示,Tecentriq+Tiragolumab联合治疗组中位生存期(mOS)达22.9个月,Tecentriq单药治疗组mOS为16.7个月,联合治疗比单药治疗的死亡风险降低19%。
罗氏预计这一研究将在2024年下半年读出OS数据,是千难万险终迎曙光,还是失败阴云继续笼罩,将有分晓。
非小细胞肺癌攻坚难
除了双免疫疗法效果各异,“IO+抗血管生成药物”以及“IO+PARP抑制剂”也是理论与实际应用存在较大差异的联用类型。值得注意的是,这两种联用类型都在NSCLC领域折戟。肺癌是全球发病率最高的恶性肿瘤之一,而超过80%的肺癌属于NSCLC。因此,NSCLC是各药企研发兵家必争之地,屡败屡战。
理论上,抗血管生成药物和免疫检查点抑制剂联合可逆转肿瘤微环境的免疫抑制状态,促进血管正常化,从而达到协同抗肿瘤作用。可瑞达(K药)+乐卫玛(Lenvima)(即“可乐组合”)在晚期肾癌及子宫内膜癌适应症获批,是IO+抗血管生成药物的经典组合之一。
Lenvima是日本卫材旗下一款口服多受体酪氨酸激酶抑制剂,能够选择性抑制多种VEGF(血管内皮生长因子)受体的激酶活性,在癌细胞生长中起关键性作用。
然而,2023年9月,“可乐组合”在非小细胞肺癌的LEAP-006及LEAP-008两项研究均未达到OS和PFS双主要终点,两项Ⅲ期临床试验以失败告终。随着“可乐组合”在NSCLC适应症折戟,业界意识到,虽然该组合缩瘤效果明显,但不代表OS获益。
IO+PARP抑制剂相比于其他试验,失败率更高。理论上,PARP抑制剂能够增加肿瘤突变负荷、提高PD-L1表达,从而增强免疫检查点抑制剂的疗效,因此与抗PD-1/PD-L1单抗可以存在协同潜力。
事实上,PD-1抑制剂联合Lynparza的组合,在子宫内膜癌、前列腺癌、小细胞肺癌的试验中,显示出的数据确实较为积极,试验仍在进行中。可是用于治疗NSCLC却也不尽如人意。
默沙东便在NSCLC领域碰壁颇多。2024年3月,默沙东宣布,KEYLYNK-006Ⅲ期试验失败。该试验的目标是评估K药联合化疗之后,再使用K药+Lynparza与继续K药+化疗相比,一线治疗无EGFR、ALK、ROS1突变的转移性非鳞状NSCLC患者的疗效与安全性,然而结果显示,K药联合化疗后再接受K药+Lynparza,不符合研究预先设定的OS或PFS统计标准。
2023年12月,KEYLYNK-008试验被停止。这项试验评估的是K药与Lynparza联合治疗转移性鳞状NSCLC患者的疗效,同样的,K药联合化疗后,再使用K药+奥拉帕利并不能显示出OS的改善。
★★★ 小结 ★★★
整体来看,免疫治疗与化疗的结合已展现出令人瞩目的成效,并在ADC领域的研究热潮中占据一席之地。然而,当免疫治疗与其他治疗手段携手时,其成果可谓喜忧参半,还有巨大的未知等待被发现。
展望未来,科研工作者将不懈追求新的疗法组合与策略探索,致力于精确筛选出最有可能从IO+疗法中获益的患者群体。
这一进程不仅有望推动未来治疗策略的个性化定制,也将极大地提升治疗的精准性和有效性,为患者带来更加确定的健康前景。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






