孤儿药创新上“高速”
发布时间:2024-02-28 15:01:26作者:张琦 吕书农来源:医药经济报

世界卫生组织对罕见病的定义为患病人数占总人口0.065%~0.1%的疾病,通常具有诊断困难和治疗选择有限的特点。在已知的7000种罕见疾病中,超过九成的疾病尚未有治疗方案。这一领域的药物研发面临着经济、科学、法规以及患者招募等多重挑战。
新药上市迈快步
罕见病的发病机制通常极为复杂,且往往缺乏合适的动物模型进行深入研究。以囊性纤维化为例,这是一种罕见的遗传性疾病,其发病机制涉及多个生物学过程,如炎症反应、氧化应激、离子转运异常等。这些过程相互交织,共同导致囊性纤维化患者器官系统的损伤和功能障碍。因此,要研发有效的药物,需要深入了解这些生物学过程,并找到能够干预这些过程的药物靶点。这就需要研发人员综合运用遗传学、分子生物学、药理学等多学科知识和技术手段,研发针对性的药物并不容易。
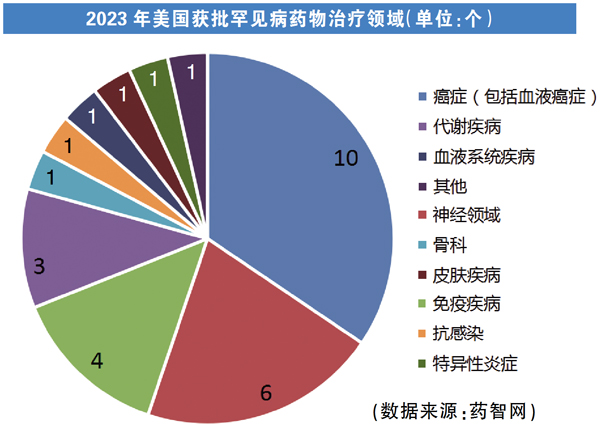
不过,即使困难重重,罕见病药研也在近年来技术的飞速发展与相关政策扶持等综合作用下,坚定地迈出发展的步伐。以美国为例,2023年,FDA药品审评与研究中心(CDER)批准了55种新药,其中罕见病药物29款。药智数据显示,其中抗罕见肿瘤新药占比为35%,其次是罕见神经领域疾病占比超过20%,抗感染、骨科、血液系统、特异性炎症等领域也有新药获批。
在国内,2023年也迎来罕见病药物丰收。根据国家药监局发布的2023年度药品审评报告,有45个罕见病用药品种获批,其中15个品种通过优先审评程序加快上市。2023年底,《国家基本医疗保险、工伤保险和生育保险药品目录(2023年)》中,全球唯一一款适用于儿童/成人I型酪氨酸血症的药物尼替西农口服混悬液/胶囊、全球首个获批上市的FcRn拮抗剂艾加莫德α、全球首个获批的C5补体抑制剂依库珠单抗等药物,实现了各自领域“零的突破”。
政策倾斜促发展
2023年对美国罕见病业界而言是特殊的一年。这一年,美国FDA开启了向罕见病领域倾斜的 “曲速计划”(Operation Warp Speed)。2020年,该计划一经推出便推动疫苗研究开发周期大幅缩短。彼时辉瑞、Moderna、强生等多家药企获得重点扶持,疫苗研发周期缩短至数月内。
2023年,FDA 生物制品评估与研究中心(CBER)主任Peter Marks宣布开启第二次“曲速计划”,本次行动旨在推进罕见病细胞和基因疗法在保证安全性和有效性的同时,快速进入市场。并且该计划有望进一步推进尚无全球统一质量安全标准的细胞与基因疗法国际监管趋同。
除布局第二次“曲速计划”外,FDA于2023年12月发布罕见病药物开发定稿指南(Rare Diseases: Considerations for the Development of Drugs and Biological Products Guidance for Industry)。该指南指出,FDA计划对正在开发的用于治疗严重致残或危及生命(SDLT)的罕见疾病药物采用“最广泛的灵活性”。在创新设计上,指南则建议申办人可提前与审评部门讨论使用创新临床研究设计的计划。
定稿指南还指出,在严重罕见疾病的临床研究中,药企可以使用外部对照,允许药研团队在研究参与者和未接受相同治疗的外部组之间进行比较。并且该指南鼓励孤儿药申办者让患者、护理人员和倡导者参与药物开发过程。此外,FDA还“强烈鼓励”申办者在所有相关儿科人群(从出生到17岁患者)中研究罕见病药物,并开发儿科药物配方,以便为最年轻患者提供准确剂量。
更多“首款”蓄势发
2024年第一季度,有两款罕见病药物值得关注,其一是 Orchard Therapeutics公司的Libmeldy(Atidarsagene autotemcel)。该药用于治疗由芳基硫酸酯酶-A(ARSA)基因突变引起的异染性脑白质营养不良(MLD),有望成为首个获FDA批准用于异染性脑白质营养不良的疗法。Libmeldy采用慢病毒载体将编码芳基硫酸酯酶-A的ARSA转基因导入到患者自体CD34阳性造血干细胞和祖细胞。该药获得了FDA的孤儿药资格、罕见儿科疾病资格和再生医学先进疗法资格,PDUFA日期为2024年3月18日。
其二是默沙东肺动脉高压药物sotatercept,PDUFA日期为2024年3月26日。sotatercept是一种激活素受体型ⅡA-Fc融合蛋白,可将ActRⅡA经过改造的细胞外域与抗体的Fc端融合,阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。
Rocket Pharmaceuticals公司的治疗严重白细胞粘附缺陷-I(LAD-I)药物Kresladi(Marnetegragene autotemcel)原定PDUFA日期为2024年3月,但被FDA延迟审查期3个月。有分析师指出,延迟主要与FDA的人员配置问题有关,而非申请本身。
Marnetegragene autotemcel是一种研究性基因疗法,含有患者自体造血干细胞,这些干细胞已用慢病毒载体进行基因改造,传递ITGB2基因的功能副本。该基因编码β-2整合素成分CD18可促进白细胞粘附,并使其从血管外渗以抵抗感染的关键蛋白质。据悉,该药在美国获得了FDA的再生医学高级疗法(RMAT)、罕见儿科和快速通道认证,在欧盟获得了PRIME和高级治疗药物产品(ATMP)认证。
新兴技术降成本
目前,罕见病药物的研发不仅有更多的政府支持与国际合作,还有技术创新、患者组织等多方积极推动,有望为全球罕见病患者带来更多有效的治疗选择。
许多国家已经认识到罕见病药物研发的重要性,并为此提供了资金支持、税收优惠和市场独占权等激励措施。这些政策可以使企业降低研发成本,提高回报率,从而鼓励制药公司投入更多资源进行罕见病药物的研发。
而随着近年来如CRISPR基因编辑技术的安全性和效率不断提高,科学家们以前所未有的精确度进行DNA编辑,开发出针对特定基因突变的治疗方法,不仅修复了有缺陷的基因,还可以调整基因表达,从而治疗更多种类的罕见遗传性疾病。除了CRISPR技术、个性化治疗、人工智能的深度学习、数据挖掘等能力也可能加速药物筛选。这些趋势不仅有助于提高治疗效果,还有望降低药物开发的时间和成本,最终为罕见病患者带来更好的治疗选择和生活质量。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






