2023中药新药稳中回升
发布时间:2024-01-30 16:35:23作者:吴俭宁 刘鑫荣来源:医药经济报
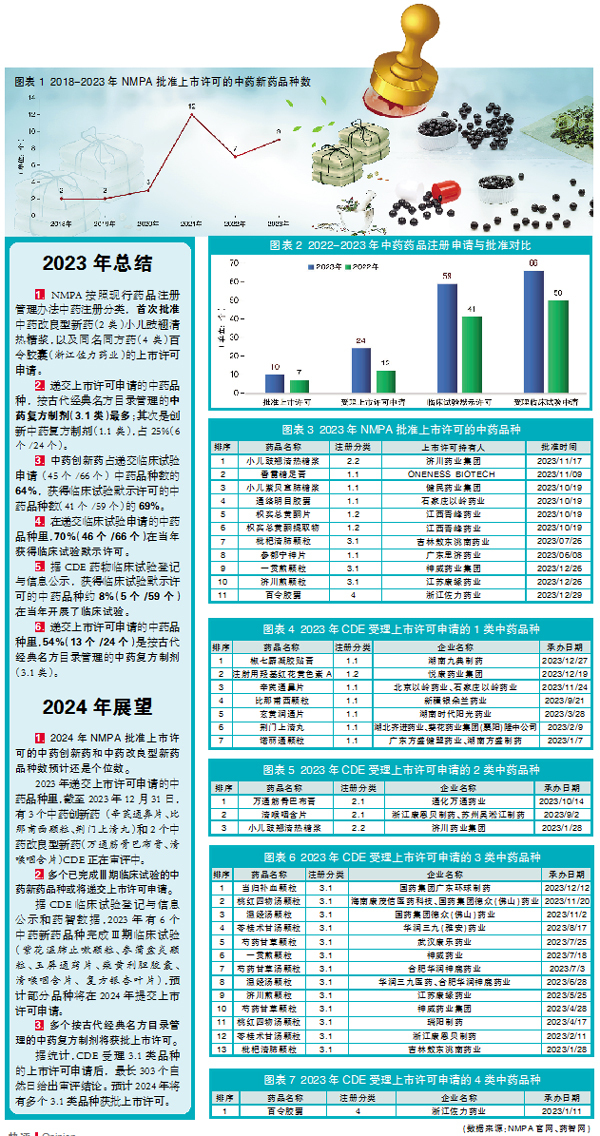
2023年,国家药监局(NMPA)共批准11个中药品种的上市许可,包括9个中药新药品种(5个中药创新药、1个中药改良型新药、3个古代经典名方中药复方制剂)、1个同名同方药和1个原料药(见图表3)。
国家药监局药审中心(CDE)受理上市许可申请的中药品种(不含原料药)24个,同比增长100%。获得CDE临床试验默示许可的中药品种(不含原料药)59个,同比增长44%;CDE受理临床试验申请的中药品种(不含原料药)66个,同比增长32%(见图表2)。
创新药临床申请踊跃
2023年,NMPA批准上市许可的中药创新药有5个,与2022年数量相当,含1.1类中药复方制剂4个、1.2类单一物质中的提取物制剂1个(见图表3)。
值得注意的是,2023年11月NMPA附条件批准了1.1类进口天然药物创新药香雷糖足膏的上市许可。该药品由台湾合一生技公司研发,以到手香和积雪草提取物为主要成分,用于清创后创面截面积小于25cm2的Wagner 1级糖尿病足部伤口溃疡。香雷糖足膏2021年3月向CDE递交上市许可申请,期间在新加坡和马来西亚等地获得上市许可,这是2012年以来NMPA唯一批准上市许可的中药、天然药物进口品种。
CDE受理了7个(比2022年减少1个)中药创新药的上市许可申请,含1.1类6个、1.2类1个(见图表4)。其中,1.1类的2个品种玄黄润通片、诺丽通颗粒,CDE建议不批准。
获得CDE临床试验默示许可的中药创新药品种(不含5个原料药)共41个,同比增长64%,含1.1类34个、1.2类6个、1.3类新药材及其制剂1个。CDE受理临床试验申请(不含6个原料药)的中药创新药品种46个,同比增长39%,含1.1类38个、1.2类7个、1.3类1个。
改良型新药年内获批
2023年,NMPA批准了1个中药改良型新药。小儿豉翘清热糖浆的上市许可,是NMPA按照现行中药注册分类批准的首个中药改良型新药。该药品2023年1月提交上市许可申请,同年11月即获批上市许可,颗粒剂改为糖浆剂降低了苦味,提高儿童用药依从性。
除小儿豉翘清热糖浆外,CDE还受理了2个中药改良型新药品种的上市许可申请(见图表5),即万通筋骨巴布膏和清喉咽含片,这2个品种均为2.1类改变给药途径。
获得CDE临床试验默示许可的中药改良型新药有16个,同比增长45%。其中,2.2类改变剂型2个、2.3类增加功能主治12个、2.2类+2.3类改变剂型同时增加功能主治2个。
CDE受理临床试验申请的中药改良型新药20个,同比增长43%。其中,2.1类2个、2.2类2个、2.3类15个、2.2类+2.3类1个。
经典名方制剂申请增加
2023年,NMPA批准了3个3类古代经典名方中药复方制剂的上市许可。吉林敖东洮南药业的枇杷清肺颗粒、神威药业集团的一贯煎颗粒和江苏康缘药业的济川煎颗粒,均为列入《古代经典名方目录(第一批)》的品种,且上市许可申请的提交均在2023年内。
CDE受理上市许可申请的古代经典名方中药复方制剂有13个,相比2022年增加10个,均为3.1类按古代经典名方目录管理的中药复方制剂,且剂型均为颗粒剂(见图表6)。其中,瑞阳制药的桃红四物汤颗粒、浙江康恩贝制药的苓桂术甘汤颗粒2个品种,CDE建议不批准。
CDE未受理古代经典名方中药复方制剂的临床试验申请。
唯一同名同方药获批
2023年NMPA批准了1个4类同名同方药即浙江佐力药业百令胶囊的上市许可,这是现行药品注册管理办法实施以来,NMPA首次批准同名同方药的上市许可(见图表7)。该药品也是2023年CDE受理同名同方药上市许可申请的唯一品种,相较2022年增加1个。
2023年获得CDE临床试验默示许可的同名同方药有1个,即四川国为制药的标准桃金娘油肠溶胶囊(成人装),与2022年数量相同;未受理该类中药品种的临床试验申请。
无“其他情形”申请
2023年,CDE未受理注册分类为其他情形(境外已上市境内未上市的中药、天然药物制剂等)中药品种的上市许可申请;无该类中药品种的临床试验默示许可,2022年有1个;未受理该类中药品种的临床试验申请。
2023年总结
1. NMPA按照现行药品注册管理办法中药注册分类,首次批准中药改良型新药(2类)小儿豉翘清热糖浆,以及同名同方药(4类)百令胶囊(浙江佐力药业)的上市许可申请。
2. 递交上市许可申请的中药品种,按古代经典名方目录管理的中药复方制剂(3.1类)最多;其次是创新中药复方制剂(1.1类),占25%(6个/24个)。
3. 中药创新药占递交临床试验申请(45个/66个)中药品种数的64%,获得临床试验默示许可的中药品种数(41个/59个)的69%。
4. 在递交临床试验申请的中药品种里,70%(46个/66个)在当年获得临床试验默示许可。
5. 据CDE药物临床试验登记与信息公示,获得临床试验默示许可的中药品种约8%(5个/59个)在当年开展了临床试验。
6. 递交上市许可申请的中药品种里,54%(13个/24个)是按古代经典名方目录管理的中药复方制剂(3.1类)。
2024年展望
1. 2024年NMPA批准上市许可的中药创新药和中药改良型新药品种数预计还是个位数。
2023年递交上市许可申请的中药品种里,截至2023年12月31日,有3个中药创新药(辛芪通鼻片、比那甫西颗粒、荆门上清丸)和2个中药改良型新药(万通筋骨巴布膏、清喉咽含片)CDE正在审评中。
2. 多个已完成Ⅲ期临床试验的中药新药品种或将递交上市许可申请。
据CDE临床试验登记与信息公示和药智数据,2023年有6个中药新药品种完成Ⅲ期临床试验(紫花温肺止嗽颗粒、参蒲盆炎颗粒、玉屏通窍片、柴黄利胆胶囊、清喉咽含片、复方银杏叶片),预计部分品种将在2024年提交上市许可申请。
3. 多个按古代经典名方目录管理的中药复方制剂将获批上市许可。
据统计,CDE受理3.1类品种的上市许可申请后,最长303个自然日给出审评结论。预计2024年将有多个3.1类品种获批上市许可。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






