获批量拐点下行 一致性评价重心转场
发布时间:2023-09-25 10:38:41作者:谭梦思来源:医药经济报
自《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)发布以来,仿制药一致性评价工作已经步入常态化。药审中心从2017年8月开始承担仿制药质量和疗效一致性评价(以下简称“一致性评价申请”)工作,对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价。
开展仿制药一致性评价,可以使仿制药在质量和疗效上与原研药一致,在临床上可替代原研药。这不仅能节约医疗费用,也可提升我国的仿制药质量和制药行业的整体发展水平,保证公众用药安全有效。
本文根据近年来国内一致性评价的申请与通过的数据,对一致性评价现状进行简单分析。
[透视2022要点]
数量首次回落
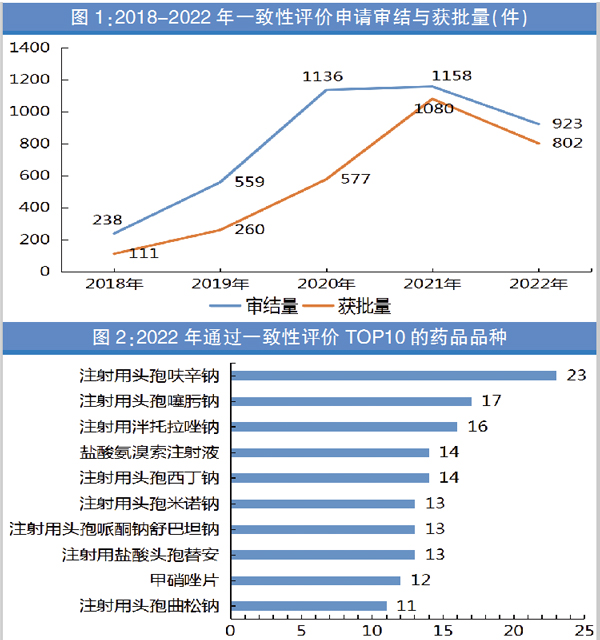
根据2023年9月6日国家药监局发布的《2022年度药品审评报告》,2022年审结一致性评价申请共923件,较2021年减少了20.3%;批准802件,较2021年减少了25.7%。2022年批准率为86.89%,2021年批准率为93.26%。这是近五年一致性评价过评数量首次出现下滑(详见图1)。
重点剂型走势
从药品品种看,2022年通过一致性评价企业数量最多的药品品种是注射用头孢呋辛钠,共有23家企业过评,该药在2021年仅有10家企业过评,可见2022年该药的仿制药竞争最为激烈。注射用头孢噻肟钠以17个受理号位列第二;注射用泮托拉唑钠以16个受理号排位第三(详见图2)。
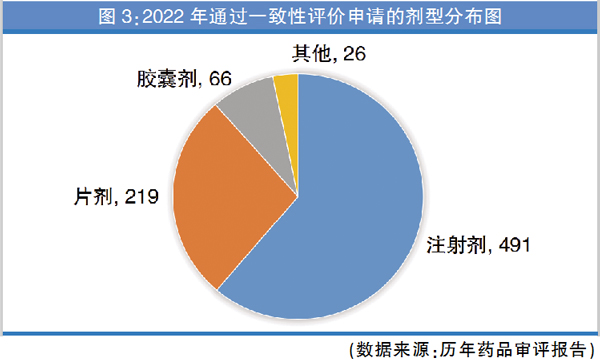
从药品剂型来看,2022年通过一致性评价TOP10品种中,注射剂占比超过90%(图2)。通过批准的一致性评价申请中,除注射剂(491件,占比61.22%)、片剂(219件、占比27.31%)、胶囊剂(66件,占比8.23%)等常见剂型外,还包括散剂、干混悬剂等产品(详见图3)。
近五年,注射剂一致性评价申报数量以及占比逐年递增,尤其是国家药监局发布的一系列一致性评价的指导原则后,注射剂一致性评价工作明显提速,2021年注射剂在一致性评价中的申报占比和过评占比创新高。从具体品种看,注射剂占比约达60%,主要是因为通过一致性评价的注射剂大品种数量较多。与第五到第八批国采相比,抗感染注射剂的比重有所下降,主要是因为该领域前期已经基本“能采尽采”。但从总体数据显示,注射剂短期内仍占主导地位。
从剂型来看,除常规的注射剂、片剂、胶囊剂外,过评中还覆盖干混悬剂、咀嚼片、口崩片、颗粒剂等剂型。同时,国家鼓励有条件的企业率先开展口服固体制剂、注射剂之外的其他剂型产品的一致性评价,缓释片、缓释胶囊、肠溶胶囊等创新复杂制剂的申报数量将持续上升。
后续一致性评价走势如何,仍需观察。
[数据回落启示]
我国仿制药质量和疗效一致性评价工作已开展多年,2021年一致性评价申请获批数量达到顶峰,2022年首次下滑。为了不让一致性评价成为一次性评价,企业除了要长远控制产品质量外,还需注意集采规则日趋完善,生物类似药集采也箭在弦上。在集采进入“常态化、制度化”的新阶段下,部分市场规模小,竞争格局激烈的老品种一致性评价将不再受青睐,企业重心将转向发展高质量、高标准的新型仿制药研发。
伴随一致性评价工作的进展,纳入带量采购的品种数量、范围也逐步扩大,此前国家层面就开展过胰岛素专项集采,为后续生物药领域集采积累了一定的经验。同时,国家医保局也多次释放出信号,将生物类似药纳入集中带量采购。生物类似药在未来几年内将陆续登场,形成较为充分的竞争状态,满足带量采购的基本前提。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






