FDA将严查临床结果瞒报
发布时间:2023-09-13 16:40:05作者:本报综合来源:医药经济报
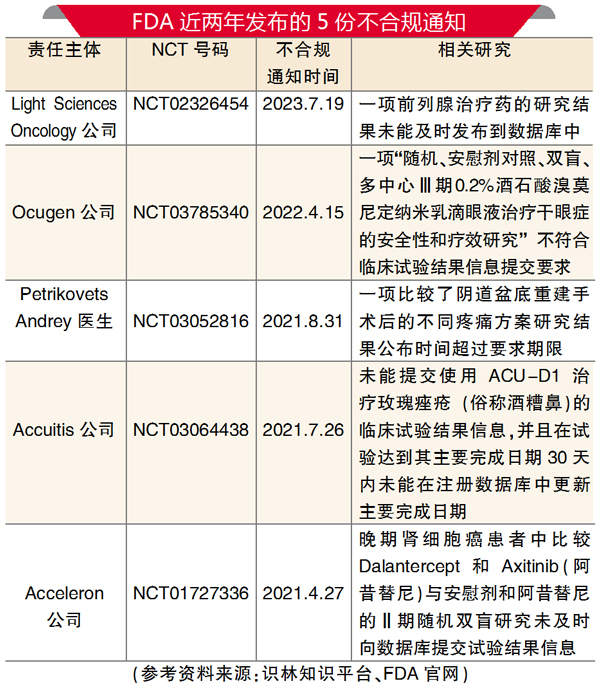
根据美国2007年颁布的联邦法律,临床试验申办人必须在首个人类受试者入组后21天内在ClinicalTrials.gov上注册相应的研究,并在通常不迟于研究完成日期后一年内(除非额外要求延长截止日期)为试验提交某些概要结果信息。但是,对于这项法律要求的执法一直很薄弱,2017年FDA生效了一项新规定,以加强法律规定的报告要求。
在全球范围,推动临床试验透明性一直是长期存在的问题。尽管不断有声音呼吁加强对未能注册临床试验和报告结果的试验申办人与研究人员的执法力度,但FDA试图解决这一问题的努力却很少。
根据FDA的清单,FDA两年前才开始发送所谓的“不合规通知”。到目前为止,FDA总共发出5份不合规通知。(本报综合)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






