中国新药注册临床试验新时效
发布时间:2023-09-11 14:21:01作者:摘自国家药监局药审中心来源:医药经济报
9月7日,国家药监局药审中心发布《中国新药注册临床试验进展年度报告(2022年)》,从药物类型、品种、适应症、申办者类型、注册分类、试验分类、试验分期、特殊人群试验、临床试验单位、临床试验首次登记用时、启动用时、数据监查委员会(DMC)、试验完成情况等角度对临床试验的总体趋势、主要特点等进行了汇总分析。主要研究结果摘要如下:
生物制品上市平均4.6年
2022年度共批准21个创新药(不含中药提取物和新增适应症品种),以国内上市许可持有人为主,占比达76.2%。化学药品占比较高,共有11个品种。从适应症分布来看,抗肿瘤药物最多,共7个品种。中药精神神经、妇科、肾脏病和消化各批准1个品种。
创新药获准上市所用时间平均为7.6年。生物制品获准上市用时最短,平均为4.6年;其次为化学药品,平均为6.9年;中药用时最长,平均为15年。
登记总量达3410项
2022年中国药物临床试验登记数量达3410项,其中受理号登记1974项,当年完成(试验状态为“已完成”,且首例知情同意日期和试验完成日期均在2022年内)129项,均为国内试验。BE(生物等效性)备案号登记1436项。
按药物类型统计,化学药品占比最高,为73.8%;其次是生物制品;中药最少,占比仅为1.9%,仍呈现逐年下降趋势。
此外,共登记了46项细胞和基因治疗产品类临床试验,间充质干细胞类临床试验最多,共12项。
目标适应症集中在抗肿瘤
化学药品适应症仍以抗肿瘤药物为主;生物制品适应症同样以抗肿瘤药物为主,其次为预防性疫苗;中药主要集中在呼吸、消化、皮肤及五官、精神神经等适应症。
新冠疫苗临床试验共39项。仅在儿童人群中开展的临床试验数量略有增加(2022年64项,2021年61项)。儿童临床试验中Ⅲ期占比最高,达40.6%。罕见疾病药物临床试验数量仍呈现增长趋势(2022年68项,2021年43项)。
Ⅰ期临床试验用时最短
申请人完成首次试验登记用时较长,受理号登记平均用时(116天)高于BE备案登记(67天),约93.4%的BE备案申请人可在2个月内完成登记并提交。
药物临床试验总体仍以国内临床试验为主,占比为91.1%(3105项)。
完成临床试验用时范围为11~258天(自然日)。Ⅰ期临床试验平均用时最短,为71.9天。
受试者招募用时缩短
临床试验启动用时为1天~207个月。中药1年内启动受试者招募的比例(21.2%)高于2021年(4.4%)。
临床试验组长单位较多的省、区、市,其临床试验的启动用时仍较长。海南和辽宁在6个月内实现100%启动试验。
2022年临床试验获批后当年启动受试者招募的用时进一步缩短,平均为3.3个月。启动效率进一步提高,总体上超半数试验(55.8%)可在6个月内启动受试者招募;6个月内启动招募比例也进一步提高,达91.5%。
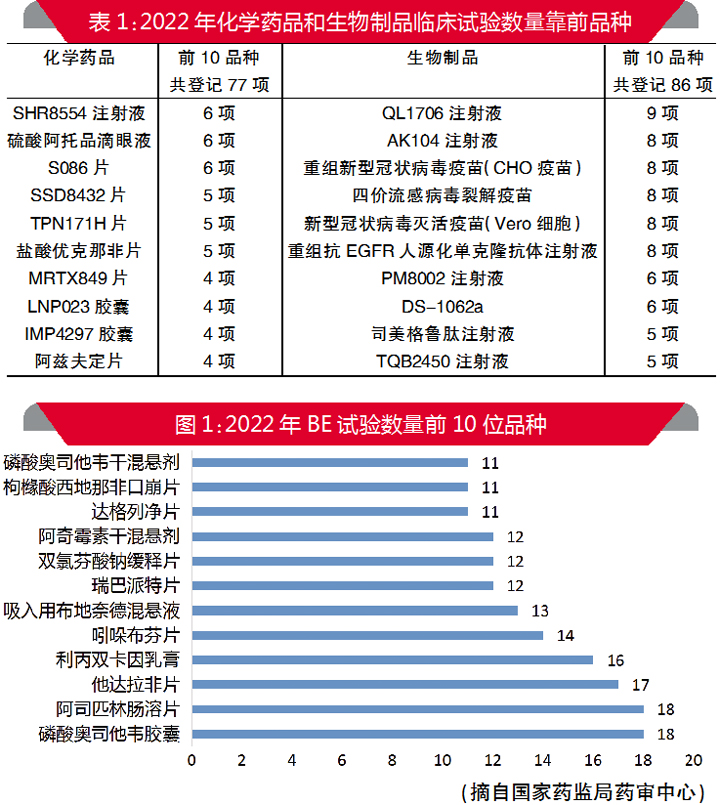
临床试验数量前10品种
按照不同药物类型分别对1974项新药临床试验所涉及的品种(按临床试验许可文件药品名称)数量进行统计。2022年,约85%的中药品种仅开展1项临床试验,开展2项以上临床试验的品种包括清肺消炎丸(3项)、行气坦尼卡尔胶囊(2项)、复方藏茴香肠溶液体胶囊(2项)和红七麝巴布贴(2项)。近年来总体趋势基本一致,多数中药品种同年仅开展了1项试验。
化学药品和生物制品新药临床试验品种情况见表1。
(9月6日,CDE也发布了《2022年度药品审评报告》,详见3版)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






