单抗赛道单挑肿瘤专注为赢
发布时间:2023-08-30 13:47:06作者:特约撰稿 孙权来源:医药经济报
中金企信国际咨询公布的《2021-2027年中国单克隆抗体药物市场专项调研及投资前景可行性预测报告》显示,随着患者基数的不断增长、新型单抗药物的推出,全球单抗市场金额将以年复合增长率10.9%的速度,2025年将增至2921亿美元,并预计继续以5.5%的年复合增长率扩容,2030年将达3817亿美元。
2020年中国单抗市场规模411亿元人民币,2016年至2020年的年复合增长率为43.2%。随着抗体药物渗透率的提升,预计2025年中国单抗市场金额将达1945亿元人民币,2020年至2025年的年复合增长率将达36.5%,并于2030年增至4447亿元人民币。
审批进程缩短
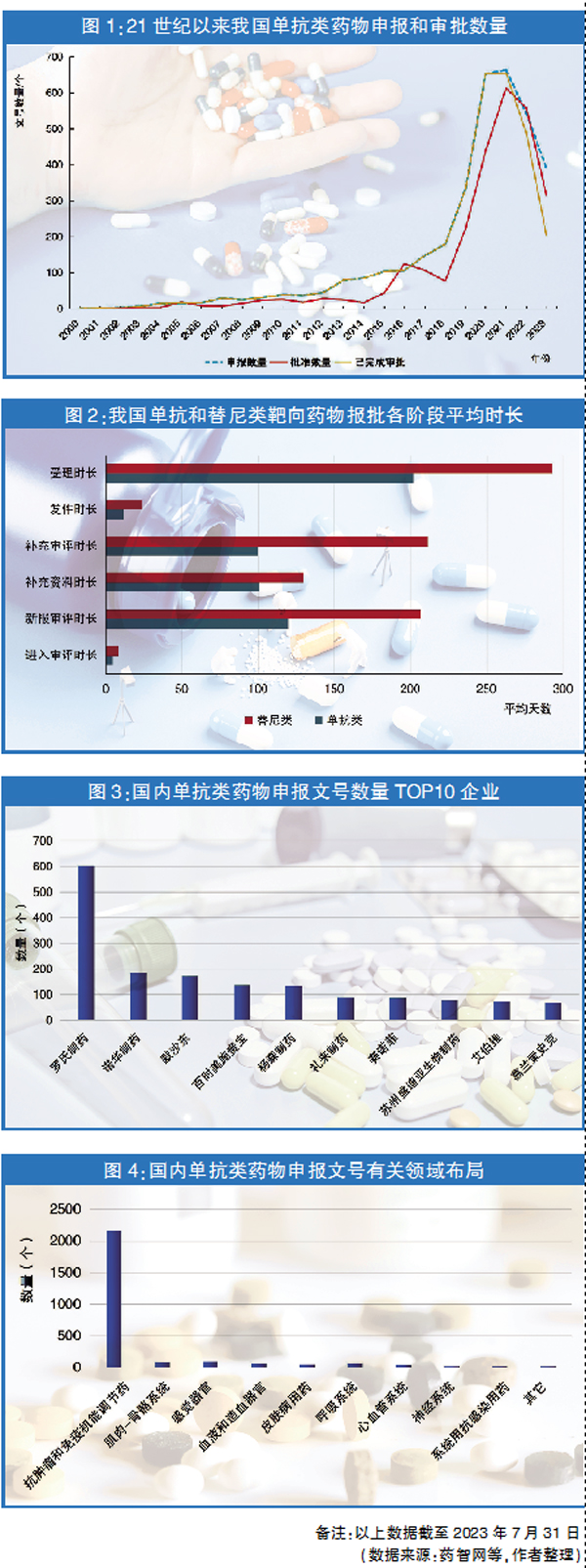
随着单抗技术难题被攻克,使用单抗进行靶向治疗的临床经验和临床路径趋于成熟,近年来全球各创新药企对单抗类药物的研发热度只增不减。药智网药品注册与受理数据显示,从21世纪初至今年7月31日,我国共有3555个单抗类药物受理文号,其中2036个文号申报临床,397个文号申报生产;有2697个申报文号已通过批准,通过率达96.6%,说明我国药审部门对单抗类创新药物的接受度较高;从申报与批准的文号数量来看,我国近年来对单抗类药物的批准数量均显著上升;从申报和审批时间来看,我国对单抗类药物的新报任务和补充任务的审评审批时间均明显短于替尼类。
更短的审批进程为受审药物所属企业赢得更多时间开拓市场。尤其对于原研创新药物,可获得长时间的专利保护期。这样既能保证制药企业市场收益,也能激励其加大相关材料研发力度,满足临床需求,同时还能激励更多内资企业关注单抗类药物研发,打破外资企业对该领域的垄断,为医疗保障相关方赢得更大的议价权。
国产替代提速
目前,国内上市的单抗多为进口药物。由于技术垄断以及市场独占等原因,多数原研单抗药物的价格极高。虽然我国医保相关部门已实现部分单抗药物的支付保障,一些企业也推出患者支持计划(PAP)以减轻患者的经济压力,但是仍存在一定数量的患者因无法支付高昂的单抗治疗费用而不能获得最理想的救治。同时,即便高昂的价格在医保谈判准入后有明显的降幅,但对于以保基本为核心要义的基本医疗保险来说,每年在单抗类创新药物方面的医保基金支出不容小觑。
在此环境下,对一些专利即将到期、临床治疗效果好的单抗药物提早布局,尽早实现“国产替代”是打破僵局的不二之选。以国内市场规模预估高达百亿元的贝伐珠单抗为例,国内贝达珠单抗已获批上市的药品中,除原研厂商罗氏外,已有3款国产贝达珠单抗获批,另外还有6款在排队等待上市批准。放眼全球,目前共有18家企业申报临床试验,其中不乏正大天晴等国内企业的身影。
不难看出,随着一部分原研单抗即将到达专利保护期,国内企业虎视眈眈,准备对其进行“国产替代”。但需要注意的是,“国产替代”之后的市场规模竞争中,价格战是无法避免的。据预计,未来3年内,还有6~7家药企的贝伐珠单抗生物类似药将获国家药监局(NMPA)批准上市。届时将有10家药企蚕食这块大蛋糕,市场份额竞争空前火热。原研药安维汀于2017年进入医保目录,目前已降价超过60%。同时,单抗纳入集采的消息不绝于耳,这使得未来“国产替代”赛道变得风云莫测。
“国产替代”是绝大多数国内企业开辟国内单抗市场的必经之路。通过“国产替代”进一步降低单抗的价格,对卫健、医保、医院和患者端都是利大于弊的结果。但对于企业而言,在选择“国产替代”何种原研单抗药物时务必慎重,以防赛道过于拥挤,无法达到预期的投资回报率。
适应症待拓展
现阶段绝大多数的单抗类药物仍以肿瘤治疗症作为原始适应症,申报抗肿瘤适应证的单抗作用靶点已涵盖HER2(人类表皮生长因子受体2)、PD-1(程序性死亡受体1)、CTLA-4(细胞毒T淋巴细胞相关抗原4)、CD20(B细胞抗原CD20)、VEGF(血管内皮生长因子)等,并均有对应靶点的单抗获FDA批准上市。
从ATC分类可知,申报文号最多的是抗肿瘤药和免疫机能调节药(2161个,占总数的82.29%);其次是感觉器官(93个,3.54%)、肌肉-骨骼系统(90个,3.43%)和血液及造血器官(66个,2.51%)等,各类占比均不超过5%。造成该现象的原因很多:一方面,肿瘤患者的基数和疾病负担相比于特应性皮炎、类风湿性关节炎等疾病要更高;另一方面,从投资回报率而言,新药研发要考虑受众患者基数、研发成本、研发难度、全球化战略等综合性商业价值,相比于肿瘤领域,其他疾病领域的单克隆抗体研发技术成熟度和临床应用经验均不占优势。因此,在创新药物研发赛道日益拥挤的当下,新药研发单位更倾向于将不确定性较低的赛道作为研发的第一站。但就开发潜力和市场竞争压力而言,抗肿瘤单抗研发赛道过于拥挤,且除单抗外的其他抗肿瘤药物研发也是近年来业界关注的焦点。现阶段,临床对自身免疫性疾病、感染性疾病的治疗以常规方案为主。临床路径亟需改革创新,无疑给单抗药物研发提供了新思路。
除了针对抗肿瘤之外的领域进行探索,相关药物研发单位还可以基于目前在抗肿瘤治疗领域卓有成效的药物,探索其治疗自身免疫性疾病、感染性疾病等的可能性。如阿替利珠单抗(Atezolizumab)被FDA批准用于治疗肺癌、膀胱癌、乳腺癌、肝癌、小细胞肺癌、三阴性乳腺癌等肿瘤疾病和类风湿性关节炎、系统性红斑狼疮、硬皮病等自身免疫性疾病的治疗,利妥昔单抗(Rituximab)被FDA批准用于治疗非霍奇金淋巴瘤、毛细胞淋巴瘤、慢性淋巴细胞白血病和类风湿性关节炎、系统性红斑狼疮、自身免疫性溶血性贫血等疾病。值得注意的是,以上两种可以同时用于抗肿瘤治疗和自身免疫性疾病治疗的单抗药物最先在FDA报批的适应症均为肿瘤治疗(阿替利珠单抗于1998年11月获FDA批准用于治疗HER2阳性乳腺癌;利妥昔单抗于1997年11月获FDA批准用于治疗低度CD20阳性、难治性、低度滤过性或非滤过性B细胞淋巴瘤)。这无疑为已获NMPA批准用于肿瘤治疗的单抗相关研发单位提供了接续挖掘该药物其他适应症的案例和选择。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






