海量临床研究法规的收集分类与精选
发布时间:2023-08-28 11:46:51作者:彭晓雯 李丹丹来源:医药经济报
全球新药临床研究的法规和指南众多。从1906年美国发布《食品药品法案》开始,到《赫尔辛基宣言》的出台,再到ICH、欧盟和美国FDA一系列指南的发布,临床研究的法规指南层出不穷。中国药监机构发布的临床研究规范性文件也数以百计。
研发人员尤其是临床试验的质量管理者,如果不掌握这些规范性文件,将无法建立正确操作标准SOP(Standard Operation Procedure),也无法解答同事提出的合规难题,更难以开展临床研究稽查。可以说,若对法规知识不能稔熟于心,这些工作将是空谈。但是,如何在有限的时间里学习和掌握海量法规指南?并且,如何从各渠道收集法规指南?如何快速阅读和进行分类?如何精选重点法规来精读?如何结合认知科学来自我提问进行理解消化和存疑则查?可谓挑战严峻。
笔者从事新药研发质量保证和稽查十余年,在学习法规方面,逐步摸索出了一套方法论。对于如何收集分类与精选学习海量临床研究法规,在此抛砖引玉。
全面收集,概览分类
毋庸置疑,学习法规的第一步是将它们收集起来,最直接的收集方式是访问药监机构的官网并下载保存。
在国家药品监督管理局(NMPA)官网可查找药品、器械、化妆品相关的法规、指导原则以及政策解读;在国家药品监督管理局药品审评中心(CDE)官网可查找中药、化学药、生物制品的临床、非临床、临床药理、生物统计等方面的法规指南,同时,CDE官网上的ICH工作办公室不仅收录了ICH的指导原则,而且已经把大部分ICH指导原则翻译成中文;在国家药品监督管理局食品药品审核查验中心(CFDI)官网可查找与药品、器械、化妆品检查相关的指导原则;在国家药品监督管理局药品评价中心、国家药品不良反应监测中心(CDR-ADR)官网可查找药品和器械不良反应报告和监测有关的指导原则;在中华人民共和国科学技术部官网可查找人类遗传资源管理相关的指导原则。
境外的临床研究法规可以搜索欧盟、MHRA、FDA、EMA等官方网站和Research Quality Assurance(RQA)等协会网站。
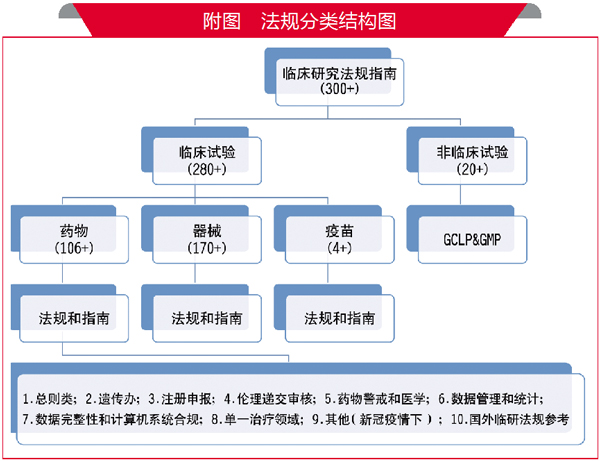
接着就是对收集到的法规按主题进行分类。附图是笔者对收集的300余项临床研究法规的分类方式。按此模式,将法规的出处、生效日期、标题、网址信息,用 Excel电子表格逐一登记,形成《临床研究法规汇总表》。
二八原则,精选重点
“二八原则”提倡的是抓重点。越是繁杂的信息,越需要挑选重点来突破。哪些是最重要的20%法规,值得投入80%的精力?显然,中国2020年最新版的《临床试验质量管理规范》(简称“中国GCP”)与我国《药品注册核查要点与判定原则》(简称“判定原则”)是研发人员需要学习的重中之重。
学习这些法规里的每一句话时,都要想象:符合其场景或文件是怎样的?不符合其要求的场景或文件又是何样貌?在执行稽查时,稽查员的核对依据就是试验方案、标准操作规程和相关法律法规的要求。因此,如果不熟悉法规,稽查员无法称职。
在这两个“最重要”法规之外,笔者还挑选了大约50个“次重点”法规,包括《涉及人的生物医学研究伦理审查办法》《药物临床试验伦理审查工作指导原则》《药物临床试验期间安全性数据快速报告标准和程序》《药物临床试验数据管理工作技术指南》等。对这些“次重点”,笔者建议按自己的理解对每一个法规写50~100字摘要,或画一个思维导图,提炼关键词成电子表格的单独一列,查询时直观又方便。关键词可用“伦理审查”“药物警戒”“注册申报”“数据管理”等。其他的非重点法规,浏览后头脑中留有印象即可。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






