46个完成审评!上半年儿药活力迸发
发布时间:2023-08-02 14:35:04作者:谭梦思来源:医药经济报
近年来,儿童用药备受业界关注。根据第七次全国人口普查统计,我国现有0~14岁人口数量大约已经达到2.5亿人次,占全国总人口的17.95%,而儿童药存在品种少、剂型少、规格少、特药少的“四少”局面,且研发生产存在起步晚、临床试验难度大、基础薄弱等问题。
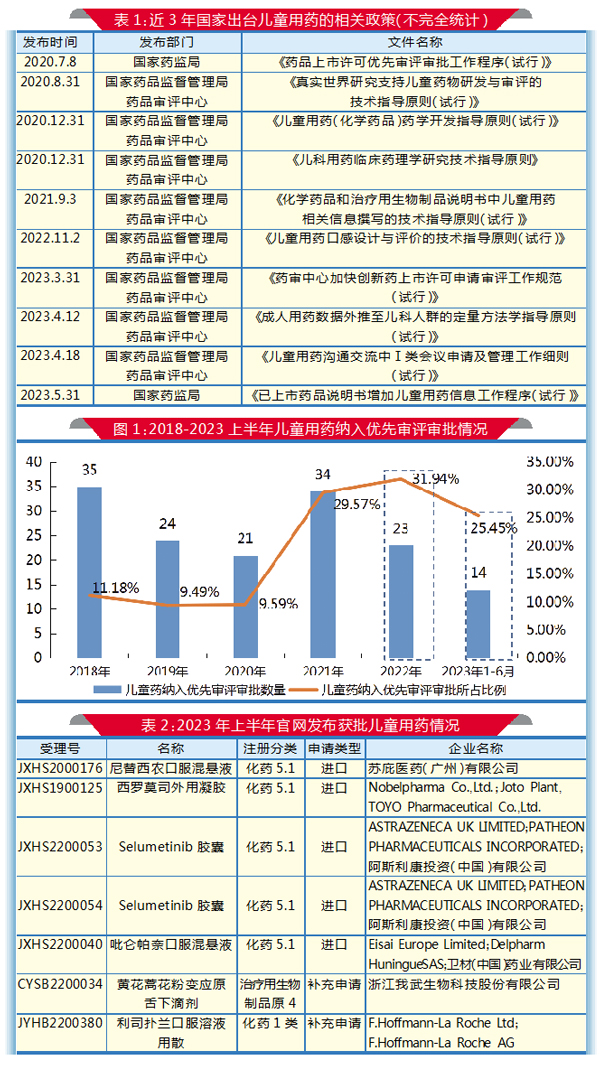
为解决这些问题,国家鼓励和促进儿童用药的研发和创新,陆续出台了一系列政策。我国儿童用药科学监管体系不断完善,2019年以来制定发布17个儿童用药相关指导原则,为企业研发注册提供了技术指导。近3年制定的儿童药研发指导涉及药学、临床、审评等相关工作(见表1),这些措施进一步鼓励了创新,更好地促进了生物医药的高质量发展。
2023年国家医保药品目录已于今年7月正式启动,儿童用药仍然是此次调整的重点之一。在申报条件方面,针对纳入“鼓励研发申报儿童药品清单”的药品不再设置获批时间的限制条件。医保药品目录准入谈判等政策也加快朝着儿童用药倾斜。
本文聚焦2023年上半年儿药审评审批,感受儿药迸发的创新活力。
审评审批概览
国家药品监督管理局药品审评中心首页热点专题下专门设有“儿童用药专栏”。根据国家药监局的数据,2022年共有66个儿童用药品种通过技术审评,相较于2021年的47个有较大幅度的提升;2023年上半年已有46个儿童用药完成了审评,数量超过去年同期。
纳入优先审评审批情况
药品优先审评审批程序无疑助力了儿童用药的加速进程。国家药监局的报告显示,儿童用药在优先审评审批的整体趋势呈上升状态。2021年共有34个儿童用药纳入优先审评审批;2022年有所下降;药智网数据显示,今年上半年共有55个药物纳入优先审评,其中14个儿童用药纳入优先审评审批。2018-2023年上半年儿童用药纳入优先审评审批的情况见图1。
上市批准/建议批准情况
在批准数量方面,2019年共有19个儿童用药获批,2020年为26个,2021年为47个,2022 年66个,企业研发申报热情高涨。从CDE儿童用药专栏可知,今年上半年共有4个品种的儿童用药通过优先审评获批上市,包括尼替西农口服混悬液、西罗莫司外用凝胶、硫酸氢司美替尼胶囊(Selumetinib胶囊)、吡仑帕奈口服混悬液;注册分类皆为化药5.1,申请类型都为进口。共有2个品种的儿童用药补充申请获批。详情见表2。
药智网数据显示,上半年除了上述4个通过优先审评获批上市的品种以外,还有蔗糖氢氧化氧铁咀嚼片(JXHS2200016)、氯马昔巴特口服液(JXHS2200015)、卡谷氨酸分散片(JXHS2200032)、地高辛注射液(CYHS2200679)和注射用双羟萘酸曲普瑞林(JXHS2200066)5个优先审评品种获批上市。地高辛注射液为国内仿制,审评结论为批准生产;其余4个品种审评结论都为批准进口。
重点领域品种
2023年上半年,完成审评的儿童用药涵盖了儿童罕见疾病、儿童多发病常见病、儿童急危重症等领域。
尼替西农口服混悬液为儿童罕见病药物,用于治疗成人和儿童酪氨酸血症I型(HT-1)患者。作为一种常染色体隐性遗传病的罕见疾病,在我国存在重大未被满足的临床治疗需求,本品上市将为酪氨酸血症I型患儿提供治疗选择。西罗莫司凝胶用于治疗6岁及以上儿童和成人患者的结节性硬化症相关面部血管纤维瘤。作为一种常染色体显性遗传性罕见病,在我国属于重大未被满足的临床治疗需求,本品上市将为结节性硬化症皮肤损害患儿提供治疗选择。硫酸氢司美替尼胶囊用于3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的Ⅰ型神经纤维瘤病(NF1)儿童患者。作为一种遗传性的多系统受累的罕见疾病,本品是全球首个也是唯一一个获批用于该适应症的靶向药物。利司扑兰口服溶液用散适应症人群扩展至“16日龄及以上脊髓性肌萎缩症(SMA)患者”。作为一种常染色体隐性遗传罕见病,SMA越早治疗预后越好,此次将利司扑兰口服溶液用散的适应症人群由“2月龄及以上”扩展至“16日龄及以上”,可将治疗窗口进一步前移,满足低龄新生儿SMA患者的迫切临床需求。
儿童多发病常见病药物黄花蒿花粉变应原舌下滴剂是一种变应原提取物,批准作为特异性免疫治疗用于经过敏原检测为黄花蒿/艾蒿花粉过敏引起的变应性鼻炎(或伴有结膜炎)的4岁及以上儿童和成年患者。作为增加儿童适用人群,本品可以填补儿童患者人群蒿属花粉变应原制剂的空白。
儿童急危重症药物吡仑帕奈口服混悬液用于4岁及以上儿童和成人癫痫部分性发作患者(伴有或不伴有继发全面性发作)的治疗。吡仑帕奈是常用的抗癫痫药物之一,国内此前已上市剂型为吡仑帕奈片剂,本品是在片剂基础上研发的口服混悬液剂,便于儿童患者服用,提高服药依从性。本品上市将为儿童患者提供更为适宜的剂型。
这些都是重点领域品种的审评审批,将对儿药市场起到重要的补充作用。
★★★ 结语 ★★★
目前我国儿童用药市场仍然存在开发周期长、研发技术难度大、安全性要求高、临床试验开展难度大等问题,许多企业望而却步。但我们也可以看到国家为破解这一困局、使国内研发技术要求与国际先进经验接轨所做出的努力。儿童用药审评审批机制不断优化,优先审评审批政策不只是纸面工作,更得到了认真落实。同时进一步完善儿童用药指导原则体系,为儿童用药研发提供重要技术支持和审评依据,激发企业的研发热情。
今年上半年46个儿童用药完成审评这一亮眼成绩单,彰显了企业研发热情高涨,在儿童药赛道上跑出加速度。不仅是原研公司申报进口,国内企业也在争分夺秒,抢占国内首仿。企业重点关注国内相关领域治疗药物的空白,以满足迫切的临床需求为导向,为儿童用药开发适宜剂型或规格。产品的加速上市,进一步满足了患儿用药需求。
相信随着政策资源的利好和医药创新研发能力持续提升,儿童药领域将产生更多惊喜,造福儿童患者。
(数据来源:国家药品监督管理局药品审评中心、药智网;搜索截止日期:2023年6月30日)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






