获批新药市场价值透视
发布时间:2023-08-02 14:24:23作者:本报研究策划中心来源:医药经济报
我国逐渐步入研发投入的收获期。据国家药监局已披露信息,本报研究策划中心初步统计,今年上半年,国家药监局共批准了43个新药(仅统计通用名首次在国内上市的药品,不包括改良型新药与新冠疫苗/药品),包括27个化药、15个生物制品以及1个中药。从注册分类来看,1类新药占比过半,达到22个。

二季度获批数量是一季度两倍
从数量来看,今年上半年可谓新药“丰收季”,较去年同期增加超过两位数。尤其是第二季度,新药获批犹如按下加速键,多达31个新药顺利通关,是一季度的两倍有余。
从申报企业来看,恒瑞医药、我武生物、阿斯利康与贝达药业收获颇丰。其中,恒瑞医药与我武生物均有3个新药“进账”。从外部引进的奥特康唑令恒瑞医药的产品线首次拓展至抗感染领域,PD-L1抑制剂阿得贝利单抗与DPP-4抑制剂瑞格列汀则分别为其抗肿瘤与代谢性疾病领域再添新兵。至此,恒瑞医药获批上市的自研创新药达13款、合作引进创新药达2款。我武生物作为国内脱敏治疗领域的龙头企业,一连获批了3个皮肤点刺试剂。
阿斯利康与贝达药业则双双增厚了抗肿瘤产品线,均获批了两个新药。阿斯利康的2个新药分别是BTK抑制剂阿可替尼与MEK抑制剂司美替尼;贝达药业除了引进自益方生物的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)贝福替尼外,还有用于肾细胞癌的伏罗尼布,后者是该公司申报的首个非肺癌适应症新药。
值得一提的是,仿制药“过评大户”齐鲁制药的创新产品也开始步入收获期,该公司首个创新药伊鲁阿克片在6月27日获批上市。
升白药百亿市场新晋两位竞争者
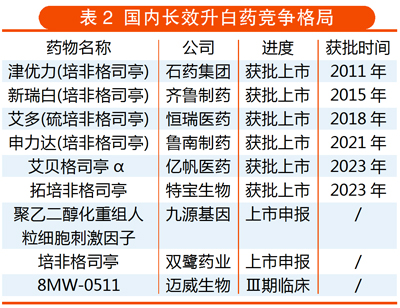
上半年,国内升白药市场迅速新增两位竞争者。5月6日,亿帆医药控股子公司亿一生物自主研发的长效粒细胞集落刺激因子(G-CSF)艾贝格司亭α注射液获批上市,用于治疗成年非髓性恶性肿瘤患者放化疗相关中性粒细胞减少症(简称“升白药”)。6月30日,特宝生物的长效G-CSF拓培非格司亭注射液也获批上市。
G-CSF是国内外临床指南首推的用于放化疗相关中性粒细胞减少症治疗药物,包括短效和长效两种类型。米内网数据显示,2021年中国G-CSF市场规模约97.2亿元,2022上半年约47.6亿元,其中长效G-CSF市场占比约70%。此前,国内上市的长效升白药已有4款,包括石药百克、齐鲁制药与鲁南制药的培非格司亭,以及恒瑞医药的硫培非格司亭。随着艾贝格司亭α注射液与拓培非格司亭注射液获批,国内百亿市场将被搅动。值得一提的是,这两个药物在中国境内的商业化权益已分别许可给正大天晴与复星医药。
事实上,竞争仍将继续升级。目前,九源生物的聚乙二醇化重组人粒细胞刺激因子、双鹭药业的培非格司亭已申报上市,迈威生物的重组人血清白蛋白人粒细胞集落刺激因子融合蛋白8MW-0511等已进入Ⅲ期临床。
此外,江苏奥赛康、天津派格生物、深圳未名新鹏生物、重庆富进生物、中美福源等均在布局长效G-CSF。
艾贝格司亭α注射液的另一关注点,在于其“出海”进程。该药在中国、美国、欧洲同步申报上市,如今,国内已获批,美国FDA于6月7日完成了对其原液生产现场的核查。据该公司预计,EMA的现场核查将在今年8月展开。若艾贝格司亭α注射液能顺利通过FDA与EMA的上市审批,将摘得“首个在中、美、欧三地上市的本土大分子创新生物药”头衔。
多个细分领域“零突破”闯关商业化
上半年获批新药中,不少是细分领域的“首个”。例如,国内首个拥有自主知识产权的NS5B抑制剂奥磷布韦、首个获批的国产CD20抗体1类新药泽贝妥单抗、国内首款获批的PI3Kα/δ抑制剂可泮利塞等。尽管头顶“零突破”光环,这些新药的商业化之路也充满挑战。
奥磷布韦:向HCV存量市场要增量
奥磷布韦为DAA核苷类前体药物,属于全基因型丙肝(HCV)治疗。直接抗病毒药物(DAA)的出现,打破了HCV的治疗僵局,HCV感染由此进入“治愈”时代。与此同时,尽管国内患者基数庞大,但随着新药陆续获批上市,治疗选择也日渐饱和,奥磷布韦将要面对存量赛道的开发。
目前,引领中国HCV市场的主要是吉利德、艾伯维、BMS、默沙东等跨国药企。此外,在国内上市的多款DAA中,歌礼制药NS3/4A蛋白酶抑制剂达诺瑞韦(2018年获批),以及凯因科技的NS3/4A蛋白酶可洛派韦(2020年获批),也是不容小觑的本土力量。
泽贝妥单抗:白热化CD20中突围不易
泽贝妥单抗为针对B细胞表面CD20抗原的人-鼠嵌合型单克隆抗体,用于治疗弥漫大B细胞淋巴瘤(DLBCL)。CD20作为淋巴瘤治疗的成熟靶点,向来是研发布局热点。除单抗外,围绕CD20的探索还有双抗、三抗、CAR-T等多种药物类型,要突出重围并不容易。
弗若斯特沙利文报告指出,中国CD20单抗市场由2018年的25.2亿元将增长至2023年的67.8亿元,预估未来将以6.7%的年复合增长率于2030年达到106.9亿元。
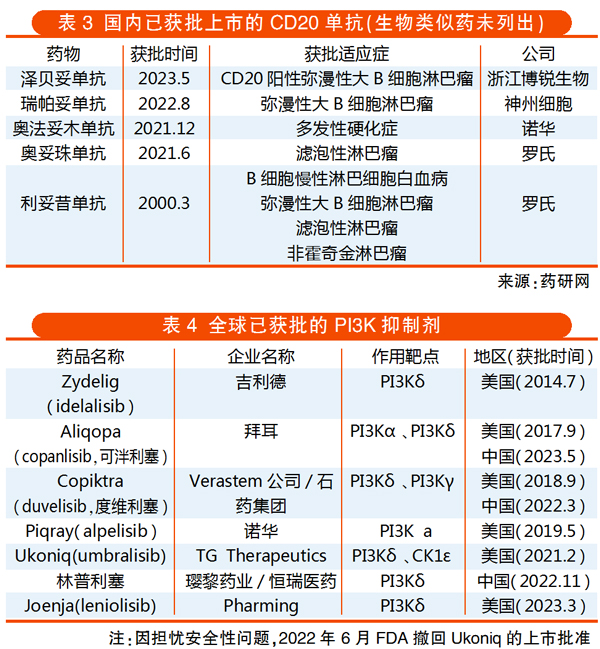
Insight数据库显示,目前国内获批上市的CD20单抗药物已有8款,包括3款进口产品,分别为罗氏的利妥昔单抗、奥妥珠单抗和诺华的奥法妥木单抗;以及5款国产药品,分别为复宏汉霖、信达生物与正大天晴的利妥昔单抗生物类似药,神州细胞的瑞帕妥单抗(原治疗用生物制品2类),博锐生物的泽贝妥单抗(1类新药)。
此外,齐鲁制药、君实生物、百奥泰等20余家国内企业也在布局CD20靶点相关药物,涉及单抗、双抗、抗体偶联药物、CAR-T、放射性药物、抗体类融合蛋白等多种类别。
PI3K抑制剂:新情况值得关注
拜耳的可泮利塞是一款静脉注射的PI3K抑制剂,能够在亚纳摩尔水平上抑制主要表达在恶性B细胞中的PI3K-α和PI3K-δ两种激酶亚型。此前,国内已上市两款PI3K抑制剂,即石药集团/Verastem的度维利塞与璎黎药业/恒瑞医药的林普利塞,其针对的靶点分别是PI3K-δ/γ与PI3Kδ。
美国FDA已批准6款PI3K抑制剂。例如,吉利德的Zydelig自上市就携带4项黑框警告,提示存在包括致命性肝脏问题在内的风险。此后因在临床研究中出现感染相关死亡等严重不良事件,遭到EMA和FDA的警告和调查,吉利德也因此终止该药的所有后续开发计划。2022年,吉利德自愿撤回Zydelig治疗滤泡性淋巴瘤和小淋巴细胞淋巴瘤两个适应症。以上情况值得企业关注,目前此药未在国内进口上市。
医保准入也是上述新药即将面临的一场新考验,根据2023年医保目录调整工作方案,这些在6月30日前获批的新通用名药品均可进行申报。若能顺利通过谈判纳入新版医保目录,将有望加快进院速度,迈出更稳的商业化第一步。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






