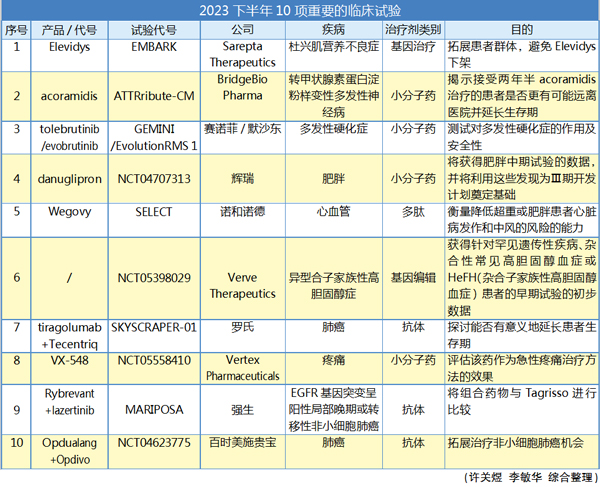
瞄准巨头下半年重磅级项目
发布时间:2023-07-25 15:32:18作者:黄晓丽 朱向晗 综合编译来源:医药经济报
今年上半年,FDA药品审评和研究中心(CDER)共批准了26个新药,较去年同期实现增长,瞩目下半年可能获批新药的同时,一些进行得如火如荼的试验犹如药企的重磅催化器,同样吸引眼球。其中有不少预期出现重要临床结果的项目所在的生物科技公司,市值至少10亿美元以上,研发后劲强,尤为值得关注。
扎堆肿瘤专场
安进公司今年下半年将有两项癌症研究可以得出结果。tarlatamab是一种双特异性T细胞衔接器,靶向DLL3,tarlatamab的Dellphi-301研究是一项潜在注册Ⅱ期研究,针对已经接受过两线或多线治疗的非小细胞肺癌(NSCLC)患者,据悉DLL3靶点在NSCLC中高度表达。不过,此前艾伯维的靶向DLL3的抗体药物偶联物Rova-T已经宣告失败。tarlatamab针对重度预治疗过的患者的Ⅰ期研究中,确认客观缓解率为23%,中位缓解持续时间为13.0个月。
安进另一项重磅肿瘤研究为Lumakras(sotorasib)正在进行的Codebreak-300 Ⅲ期临床试验,主要在至少经历过一线治疗的KRAS G12C突变的转移性结直肠癌患者中进行,1:1:1随机分为3组:Sotorasib 960mg联合Vectibix(Panitumumab),Sotorasib 240mg联合panitumumab,或研究者选择方案(屈氟尿苷联合替匹嘧啶,或瑞戈非尼),主要终点为PFS。有潜力与Mirati公司的Kras抑制剂Krazati竞争。
2022年,Krazati的Krystal-1研究数据支持该药联合西妥昔单抗(Erbitux)获得突破性疗法指定,用于治疗KRAS G12C突变的晚期结直肠癌患者,在Krystal-1试验中,针对的是既往治疗中位数为3的患者,最终得出的确认客观缓解率为46%。而安进早期的Codebreak-101研究针对接受过较重度治疗的患者,该研究得出的ORR是30%。
Point Biopharma公司正利用PNT2002与诺华的放射性配体疗法Pluvicto抗衡,这两种药皆用于治疗晚期转移性雄激素阻断疗法抗性前列腺癌。PNT2002的疗效已经显现,在其Splash试验的27名患者的安全性及剂量测定先导队列中,得出的中位射线无进展生存期为11.5个月。现在,这项研究随机分组的部分数据也即将公布。
PNT2002与Pluvicto竞争结果近期不太可能有结论,至少需要诺华给出其同等研究PSMAfore的全部详细数据,该数据可能在今年10月的ESMO上公布。
另外,还有几个大型药企的肺癌和乳腺癌治疗药物临床验证数据待公布。
治疗肺癌药物方面,百时美施贵宝(BMS)公司的第一个靶向Lag3的数据即将出炉,其目的是将Lag3和PD-1抗体组合药物Opdualag推广至已获批准的黑色素瘤治疗领域之外的肺癌适应症。预计今年将开展Ⅱ期临床观察。该研究纳入了420例一线转移性NSCLC患者,Opdualag联合铂类双药化疗与Opdivo联合化疗的结果进行对照,主要指标为不良事件和总缓解率。
再生元公司的竞争性药物Lag3抑制剂弗安利单抗(fianlimab)与Libtayo(cemiplimab/西米普利单抗)联合应用治疗晚期NSCLC正在进行Ⅱ/Ⅲ期临床两项研究。其中,一项伴有化疗,一项没有化疗,临床试验近期已开始招募。
在一项名为3475-A86的肺癌治疗研究中,默沙东的Keytruda皮下制剂已成为肿瘤催化剂优势疗法的潜在药物。当该静脉给药制剂在2028年失去专利权时,这可能是维持Keytruda稳定销售的关键。因此,默沙东一直在关注一项使用6周剂量的上述单独临床试验。
治疗乳腺癌药物方面,阿斯利康公司的Akt抑制剂Capivasertib用于一线三阴性乳腺癌治疗的临床数据亦待发布。Capitello-290研究是将Capivasertib联合紫杉醇与紫杉醇单药比较,总生存期作为主要指标。Akt抑制剂Capivasertib联合Faslodex(氟维司群)已在雌激素受体ER阳性Her2阴性乳腺癌治疗中取得了积极疗效,该药物的审批期限是第四季度。罗氏公司此前与之竞争的Akt抑制剂新药帕他色替(ipatasertib)却已在临床中遭遇了许多挫折。
市场投资者还在等待第一三共和阿斯利康公司的Destiny-Breast06研究的试验数据,该研究是探索德曲妥珠单抗能否扩展至HER2超低表达人群的治疗。
开拓FcRn新赛道
当跨国大药企纷纷期待重要的肿瘤学催化剂新技术突破时,Argenx和强生公司正在将FcRn(The neonatal Fc receptor)即新生儿Fc(Fragment crystallizable/可结晶片段)受体技术推向全新的治疗领域。在接下来的12个月里,针对FcRn抗体还有众多临床数据待验证。
今年6月底,Argenx公司的Vyvgart Hytrulo获美国FDA批准,用于治疗抗乙酰胆碱受体抗体阳性的全身型重症肌无力(GMG)成人患者,也是首个治疗GMG的皮下制剂。该药物的静脉制剂Vyvgart于2021年获FDA批准。
7月17日,Argenx宣布皮下制剂Vyvgart Hytrulo针对慢性炎性脱髓鞘性多发性神经病(CIDP)的ADHERE研究的正面结果,结果显示:该研究达到了主要终点(P=0.000039),与安慰剂相比,Vyvgart hytrulo的复发风险显著降低。
Vantage公司预告,Vyvgart Hytrulo的效果至少要与免疫球蛋白一样好,这是CIDP的治疗标准,且活性剂与安慰剂之间的复发率差距需要接近40%。
虽然重症肌无力依旧是FcRn领域的主要治疗方向,但强生公司希望得到更多的是类风湿关节炎(RA)方面的验证数据,这是一个更大的商业机会。
强生公司开展的Ⅱ期临床研究比较了每2周静脉给药1次nipocalimab与安慰剂的效果,两组均接受标准治疗。该试验针对某些与RA相关的自身抗体疾病人群,并纳入了肿瘤坏死因子(TNF)难治性患者。
整个试验的主要终点是第12周时关于DAS28-CRP(疾病活动度指标)相对于基线的变化。艾伯维公司的Jak1(非受体型酪氨酸激酶)抑制剂乌帕替尼缓释片(Rinvoq)治疗RA设定的疗效标准是安慰剂和治疗药物之间的差值约为-1.3。然而,Rinvoq也有一个加框警告。因此,nipocalimab的安全数据或许是一个优势。
挖掘GLP-1适应症
随着GLP-1受体激动剂逐渐开拓出降血糖、减肥适应症,并开向空白的NASH市场,该类药物也因副作用和潜在危险因素而出现负面新闻,不过,诺和诺德预计在今年晚些时候发布其为期5年的SELECT临床试验结果,依旧值得关注,SELECT是一项涉及17500名患者的大规模研究,以评估Wegovy能否降低有心脏病史的超重或肥胖人群发生中风或心脏病等重大心血管事件的风险。
Vantage已经预测过,SELECT试验如果能够降低17%的心血管不良事件,以及像一些分析师建议的那样,比起安慰剂组能够改善20%,会被认为是非常成功的心血管候选药物。
对于诺和诺德而言,如果想保持Wegovy领先于礼来的Mounjaro的地位,这一次胜利可助力其迈进一大步。
小结
除了以上三个方面,其他研发领域也有大药企紧跟(见前文附表),期待下半年的在研项目能继续开花结果。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






