专利补充实验数据审查接轨国际
发布时间:2023-07-05 11:04:53作者:郑希元来源:医药经济报
笔者近期在一个行业论坛上通过案例分享了国家知识产权局有关补充数据的相关内容,并强调在专利申请审查过程中补充数据的可能性。在题为“补充实验数据中外实践分析”的主题演讲,笔者梳理了补充实验数据在中国医药专利实践中的发展变化历程、中欧美专利制度创造性审查的补充实验数据规则及其相关案例。
由于药物及其制备方法与用途在总体上属于化学领域,具有实验性强、能否实现或实施结果难以预测等特点。因此,化学领域专利申请对实验数据有特殊的要求。而在创造性评判中,往往需要对实验数据进行证实或辅助说明。说明书中,通常应包括实施例,如产品的制备实施例和应用实施例,技术效果常常依赖于实验证据的证实。然而在现实情况下,申请人提交专利申请时,很难也不太可能检索到所有的现有技术,并预期到专利审查程序、专利复审与无效程序,以及司法程序中所引用的对比文件,或实验并未全部完成,或者处于暂时保密的需求,因此,申请人往往会选择在申请日后通过补交实验数据的方式,以证明发明相对于现有技术产生了某种预料不到的技术效果,或发明满足说明书充分公开的要求。
评判思路三步走
针对补充实验数据,建议相关企业遵循以下评判思路。
第一步:补充实验数据作为一份证据,是否具备相应的证据资格,应当考虑其是否具备证据能力,即是否具备真实性、合法性和关联性,以及是否满足相关程序上的要求。如果是,则进入第二步;如果不是,则不予接受该补充实验数据。第二步:核查补充实验数据待证明的技术效果,并与原申请文件记载的技术效果相比较,考察二者是否一致。如果一致,则补充实验数据应当予以接受,进而进入第三步;如果不一致,则不予接受。第三步:结合补充数据,判断发明是否具备授权条件。
中外要求有异同
实际上,在创造性审查中,欧洲与中国对补交数据的要求基本一致;而美国标准则相对宽松。关于补充数据,中美双方签署的中美第一阶段经贸协议第1.10条也有涉及:(一)中国应允许药品专利申请人在专利审查程序、专利复审程序和司法程序中,依靠补充数据来满足可专利性的相关要求,包括对公开充分和创造性的要求。(二)美国确认,美国现行措施给予与本条款规定内容同等的待遇。
中国《专利法》和《专利法实施细则》未对申请日之后提交的补充实验数据进行规定,仅在自2020年9月12日起施行的《最高人民法院关于审理专利授权确权行政案件适用法律若干问题的规定(一)》第10条,以及《专利审查指南》中作出相应规定。另梳理得出,不同版本的《专利审查指南》对于补充数据的审查原则所作出的具体规定有一定的差异(如下表所示)。
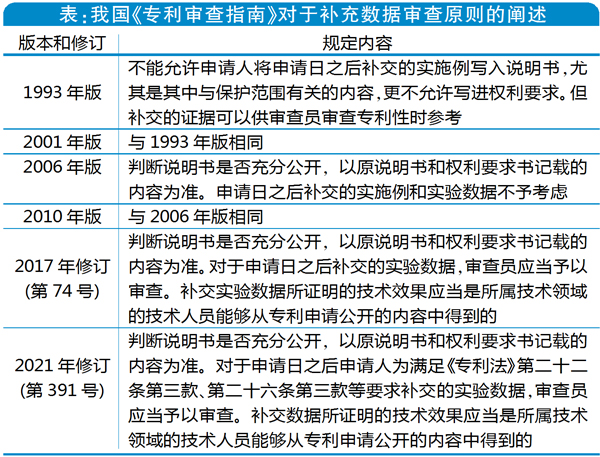
审查尺度渐放宽
根据表中第391号修订新增相关内容,国家对于补充实验数据的审查尺度是有所放宽的。笔者以为,中国医药专利的稳定性将进一步提高,无效难度会增加,审查制度将逐渐接轨国际标准,比如美国专利及商标局(USPTO)的审查标准。 与此同时,尺度放宽也可能带来一些新问题,例如专利申请人/专利权人可能会为了获得更早的申请日或优先权日,而在专利申请中记载大量未经证实的技术效果,之后通过补充实验数据的方式去证明其中的某些技术效果,从而获得专利授权或者维持专利权。针对专利申请人/专利权人上述不当获利的行为,需要相关主管部门根据审查实践中的具体情况,不断调整和明确补充数据的接受标准。
(作者系北京大学的药学专业博士、医药专利律师)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






