电子化和信息备份痛点将破解
发布时间:2023-06-12 11:15:42作者:韩广源(广东医疗器械管理学会会长)来源:医药经济报
[编者按] 为加强医疗器械经营质量管理,规范医疗器械经营管理行为,保证医疗器械安全、有效,近日,国家药监局综合司发布《医疗器械经营质量管理规范(修订草案征求意见稿)》(下称《征求意见稿》),对外公开征求意见,意见截止时间为6月29日。相较旧版,《征求意见稿》有哪些新变化?对医疗器械经营更加明确的合规指引和要求,将给行业规范发展带来怎样的拉动?《医药经济报》特邀行业专家就此作解读。
梳理发现,《征求意见稿》共十章113条,体现了国家“放管服”改革要求,强化全链条监管。
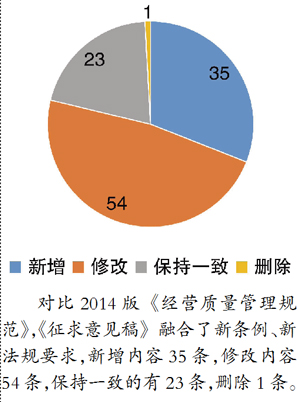
对比2014版《经营质量管理规范》(共九章,66条),此次《征求意见稿》新增“质量管理体系建立与改进”,其余章节则保持一致。新增章节从“质量体系建立”“质量方针与目标”“履行主体责任”“体系自查”“持续改进”五个方面规定医疗器械经营企业和从业者需要建立健全的质量管理体系。强调了经营企业不但要考虑经营模式的创新和利益点的提升,更要将质量管理体系与日常医疗器械业务经营相融合,通过加强采购、使用、跟踪等环节的管控,提升产品的质量管理成效。
重点关注六大变化
具体来看,《征求意见稿》主要有六大变化:
1.进一步明确适用范围
《征求意见稿》在第三条【规范执行】明确医疗器械注册人、备案人销售其注册或者备案的医疗器械产品(即自产自销的情形),以及医疗器械流通过程中涉及的贮存与运输环节(即第三方物流贮存运输),也应当执行本规范的相关要求,对规范的适用范围作了定义,给业界更加明确的指引。
2.新增电子化管理要求
自2020年10月试点发放医疗器械电子注册证以来,国家药监局已陆续公告发放药品、医疗器械、化妆品注册证等25种涉企电子证照,强调电子证照与纸质证照具有同等法律效力。《征求意见稿》顺应时代发展,在多个条款增加电子化文件、信息化系统的描述。例如第六条【电子证照】、第四十三条【零售的经营场所】(五)自动售械机、第五十八条【收货单据】鼓励企业采用电子文件方式留存、第六十八条【三方物流贮存区隔】通过计算机信息系统区分自营与受托器械等。
同时也考虑全面,在一些条款增加了对信息备份和追溯提出更高安全性的要求。如第二十一条【记录保存】新增规定,使用计算机信息系统存储的质量记录数据,应当采用安全可靠的方式存储各类数据,定期备份并确保备份数据存储安全,防止损坏和丢失。
3.特别关注网络销售和第三方物流
近年来,我国医疗器械行业进入黄金发展期,行业情况和市场环境发生很大变化。《征求意见稿》兼顾历年发布法规的融合,在第十七条【质量机构职责】、第七十六条【禁止销售情形】、第一百一十一条【三方附录】等条款均收录了第三方物流和网络销售的细化要求,体现了监管的联动。随着行业的飞速发展,医疗器械网络销售和第三方物流亟待规范。
去年,相关部门发布《医疗器械经营质量管理规范附录:专门提供医疗器械运输贮存服务的企业质量管理》,随后《医疗器械经营质量管理规范附录:专门提供医疗器械运输贮存服务的企业质量管理现场检查指导原则》也出台,对相关领域需要满足的要求予以规范,体现出药监部门不断建立完善行业规则、积极解决行业痛点的决心。
4.条款要求更为具体
《征求意见稿》用更清晰的条目罗列或详细说明了具体要求,明确管理尺度,便于企业执行和监管核查。如第四十四条【零售医疗器械陈列】、第五十一条【经营产品资质审核】、第六十二条【进货查验记录内容】等均提出“至少应该符合以下(一)、(二)、(三)”的要求。第二十六条【特殊品类经营人员要求】中进一步细化从事植入和介入类医疗器械采购或销售工作人员的专业可以为“基础医学、预防医学、临床医学、医学技术、口腔医学、中医学、护理学等专业”。
5.持续加大行业监管
从《征求意见稿》一些条款的变化修改,能明显感受到未来医疗器械经营管理的尺度趋严。不过,实际执行过程中,企业是否存在困难、能否完全执行到位,还需要参考行业的反馈。
例如,第七十七条【购货者要求】明确销售前应当索取购货者对所采购医疗器械的使用需求说明以及不得进行再次销售的书面承诺。证据的留存对于追溯来说固然重要,但也要考虑实际操作层面是否可行。第十五条【质量安全会商】明确企业负责人应当每季度至少听取一次质量负责人工作情况汇报。设定初衷是为了更好把控医疗器械质量安全风险,但规定过细是否合适,还有待商榷。
6.重点强化售后管理
重点关注质量,对出现质量问题的产品进一步严格管理。例如,第六十四条【冷链验收】明确对销后退回的冷藏、冷冻医疗器械产品还应当核实售出期间的温度记录,验收不合格的应当注明不合格事项及处置措施。第七十条【在库检查记录内容】提到对发现存在质量问题的医疗器械,应当立即进行质量隐患产品隔离并标识,防止其销售出库,并及时通知质量管理机构进行质量判定与处理。第七十二条【效期管理】对超过有效期的器械增加要求。这些都是《征求意见稿》增加的修改点。
科学推进风险治理
对比国家药监局每月公布的《各省医疗器械许可备案相关信息》近1年的数据(2022年4月30日-2023年4月30日),全国医疗器械仅经营备案这一项的数量就达16余万张,监管挑战巨大。同时,互联网+的不断发展,医疗器械网络交易和销售日趋活跃,不同形态的经营渠道进一步拓宽,也带来一些新问题。
对医疗器械行业近两年经营相关的行政处罚案例分析后可以看出,大多数违法行为是由于违反医疗器械行业分类监管机制而导致,比如不符合某一类医疗器械所要求的生产条件、技术要求,或生产条件中的诸多因素如生产场所、储存场所不符合相应的条件等。
从企业的角度看,目前医疗器械经营存在的主要问题在于整体的医疗器械经营市场秩序仍需进一步规范。自去年《医疗器械经营监督管理办法》发文后,各地都在陆续开展医疗器械生产经营“分类分级”监管工作。去年9月,相关部门还补充发布了《关于加强医疗器械生产经营分级监管工作的指导意见》。不过,目前在具体执行上还有待进一步细化,如对长期监管信用状况较好的企业,如何酌情下调监管级别等。
如何进一步提升监管效能、推进风险治理,实现医疗器械质量监管水平新提升成为新课题。《征求意见稿》正式实施后,不仅能更好地解决上述问题,对促进行业高质量发展提供了良好的执行指引,也为进一步加强医疗器械经营环节的监管,为我国后续形成良好医疗器械全生命周期监管环境打下坚实基础。融合网络销售和第三方物流的条款,配合其他细则的释出,多措并举,推进医疗器械经营行业健康发展。
总之,国家经营医疗器械相关政策的颁布与逐渐完善对器械企业和第三方物流企业提出了更高的要求。如何采用新技术“装备”现代物流,并提升合格医疗器械安全供应保障和可追溯的服务,将成为今后的发展方向。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






