痛风研发管线汇聚亚洲
发布时间:2023-05-29 10:44:02作者:陈昕朦 王迪 综合编译来源:医药经济报
长期以来,痛风一直是药物开发商默默耕耘的领域。但5月中旬,这一疾病治疗成为行业关注焦点。原因在于,美国联邦贸易委员会(FTC)在反对批准安进收购Horizon公司时指出,Horizon生产的痛风药物Krystexxa具有垄断性。
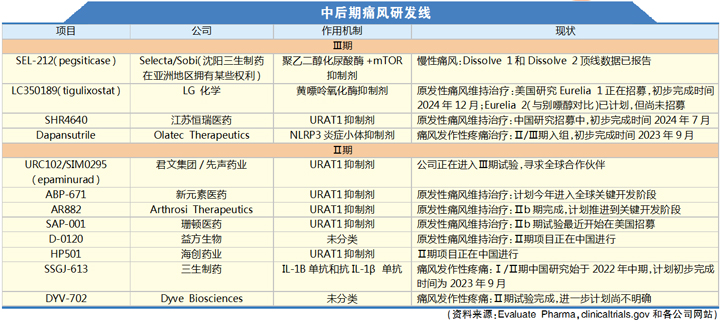
对行业的痛风研发线进行考量,似乎可以为FTC的立场提供一些支持。在慢性痛风治疗领域,目前只有一个研发项目可能会很快向Krystexxa发起挑战,即Selecta和Sobi公司的SEL-212,该药预计明年向监管机构提交上市申请。除此之外,这一领域的研发工作主要由亚洲开发商进行,且研发项目以区域为重点。
聚焦亚洲元素
痛风可以采用不同的药物进行治疗,这取决于疼痛性关节炎的发展情况。但是,药物毒性在所有治疗阶段都是一个普遍存在的问题。别嘌醇(Allopurinol)是一只有50年历史的痛风老药,对于不再使用止痛药或类固醇的患者,该药仍然是一种主要治疗药物。但是,别嘌醇会引起严重的超敏反应,尤其是亚裔和黑人人群。一般来说,亚裔人群患痛风的风险更高,这或许可以解释为什么亚洲有大量药企正在从事相关的研发工作。
这些研发项目中,大多数都在寻求向市场提供别嘌醇或非布司他的替代性治疗产品。非布司他是一种通用型黄嘌呤氧化酶抑制剂(XOIs),通过减少身体产生的尿酸而起作用。非布司他在失去专利保护之前由武田公司以Uloric的品名销售,但自2019年以来,该药一直携带黑框警告标志,提醒患者服用该药可能会因心脏问题而导致死亡风险的增加。
在亚洲,大部分开发工作集中在发掘更加安全的XOIs。西方开发商在这一领域几乎缺席,这可能是因为一系列令人失望的事件压制了它们的兴趣,以及早期疗法已经进入了高度仿制化的市场。
以Krystexxa为例,尽管它是最畅销的痛风品牌药物。该药繁冗的研发历程曾导致Savient公司破产,后几经转手落到Horizon公司的手中。Ardea公司开发的Lesinurad被阿斯利康以12亿美元收购,最终却没有带来回报。Lesinurad是一种URAT1抑制剂,由于该药可能与肾衰竭存在关联,FDA要求其开展上市后研究,2016年被当时的所有者Ironwood公司撤出市场,这进一步降低了其对抗廉价仿制药XOIs发展前景的预期。
寻找更加安全的URAT-1抑制剂正在进行之中,江苏新元素医药科技有限公司(Atom Bioscience)可能很快就会加入后期研发行列,该公司声称其相关Ⅱ期研发项目没有出现严重的副作用,计划今年启动一项全球关键性项目。江苏恒瑞的一款URAT1抑制剂已经进入Ⅲ期试验阶段,但目前尚不清楚该项目是否将针对国外市场进行开发。
韩国的LG化学和中国的珊顿医药(Shanton Pharma)也表达了进军全球的雄心。它们可能会面临与lesinurad的开发商相同的商业挑战,尽管它们都声称拥有更加安全的选项。
但不管怎样,Krystexxa仍有望在一段时间里领衔慢性痛风的治疗市场。
寻找更安全产品
痛风是一种代谢性关节炎,由尿酸在关节中积聚所引起,会导致严重的炎症和疼痛,并形成被称为痛风石的损容性肿块。基于尿酸酶的治疗产品可以分解关节中导致痛风石的尿酸盐结晶,它们已经被开发用于难治性或慢性痛风。在这个阶段,患者对XOIs的治疗不再作出反应。然而,开发尿酸酶之类的产品供患者长期使用已经被证明并非易事。
Krystexxa是第一个被证明有疗效的聚乙二醇化尿酸酶,但其上市销售携带了冗长的黑框警告信息,表明有可能引发过敏反应、输液反应以及与葡萄糖-6-磷酸脱氢酶(G6PD)缺乏相关的溶血和高铁血红蛋白血症。
患者使用这种药物前,需要预先使用抗组胺药和静脉注射类固醇,每两周静脉注射1次,时间至少长达2小时。除了过敏反应的风险以外,在治疗的前几个月里,它还经常导致痛风发作增加。尽管如此,Krystexxa今年的销售额仍有望达到8亿美元。
市场无疑在期待更加安全的基于尿酸酶的治疗产品,即使出现的产品没有在Krystexxa治疗功效的基础上加以改进,仍然可能会有市场需求。来自两项关键性试验的顶线结果表明,Selecta和Sobi的SEL-212可能达到要求,不过,相关的完整试验数据尚未公布。
SEL-212含有聚乙二醇化重组尿酸酶,结合了Selecta公司的免疫耐受技术,被称为ImmTor免疫耐受平台,据说可以降低免疫原性。在接受Krystexxa治疗的大约40%的患者中检测到了抗药抗体(ADA),这些抗体降低了该产品的功效,并导致发生严重的过敏反应。
一项交叉试验比较表明,高剂量的SEL-212与Krystexxa之间的治疗反应率相似。在Dissolve试验中,47%~56%的患者满足主要的反应标准,而在Krystexxa的药品标签上,反应率为38%~47%。
Krystexxa联合甲氨蝶呤时以反应率71%胜出,尽管这并不是所有患者会选择的治疗方案。
此外,与安慰剂组相比,使用SEL-212的患者没有报告痛风发作的增加。不过,在整个项目中,发现了两例过敏反应。
这些研究数据是否达标将很快由监管机构做出评判。瑞穗公司分析师估计,SEL-212在美国市场上的销售潜力在5亿~10亿美元之间,但值得注意的是,这一研发项目此前曾让人失望,在一项Ⅱ期研究中它未能击败Krystexxa。
还有一些开发商正在寻求解决痛风发作相关的疼痛。诺华开发的 Ilaris在欧洲获得了批准,不过,FDA长期以来一直拒绝批准这种白细胞介素治疗痛风的方法,诺华和再生元相关产品为此都遭到了拒绝。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






