FDA加速批准改革急踩刹车?
发布时间:2023-05-22 10:33:13作者:石军 综合编译来源:医药经济报
近日,美国FDA咨询委员会专家以8:6的微弱优势,支持Sarepta Therapeutics和罗氏联合开发的基因疗法SRP-9001通过加速批准通道上市,治疗杜氏肌营养不良(DMD)患者。一些分析人士预计,如果该药获得批准,其年销售额将超过30亿美元。
这让人联想到Sarepta的另一款DMD用药Exondys 51,该药于2016年获FDA加速批准,但目前仍暂未提供确凿的研究数据。
就Exondys而言,Sarepta的确证性研究甚至是在该药获得批准4年之后才启动,而这项研究工作到2024年才会完成,也就是在它开始在市面上销售8年之后。
这种情况并不罕见。彭博新闻社对美国FDA数据库所做的一项分析发现,截至今年4月,针对19只加速批准的药物所进行的验证性试验仍被列为延迟状态。其中包括超过了正式要求完成日期的研究,以及落后于原计划的试验。此外,另外7只加速批准的药物,虽然研究进度落后于计划,但并没有被归类为延迟,因为制药公司已经向FDA提交了一些数据。
加速批准变味?
加速批准路径于1992年设立,部分原因是为了在漫长的临床试验完成之前,让患者得到有希望的HIV治疗药物。患者对治疗药物的渴求促进了这一计划的诞生,时至今日这仍是一股推动力量。这一路径可以让FDA快速批准一只新药,前提是,如果早期试验结果表明新药“很有可能”发挥治疗作用。
对制药公司来说,加速批准最初只是它们向患者尽快提供新药的一种相对隐晦的方式,但是现在,它已经成为一些公司的一种商业模式。批评人士认为,FDA没有采取足够的措施,迫使制药公司提供其正在销售药物的确凿疗效数据。
当FDA在2016年批准Exondys时,也意识到做出了一个有争议的决定。Sarepta也曾经寻求Exondys在欧洲获得批准,但是欧洲监管部门在2018年拒绝了该公司的申请,并称这些研究“不能充分地表明该药是有效的”。Sarepta对这一决定提出了上诉,但监管部门没有做出任何改变。自那时起,Sarepta又通过加速审批途径在美国获批了两只用来治疗肌肉萎缩症的药物。到目前为止,Sarepta已经从Exondys 51及其两种相关药物的销售中获得了超过25亿美元的收入。
非营利智库美国国家健康研究中心主席Diana Zuckerman表示,Sarepta的药物获批是执法监督缺乏的一个典型案例。Sarepta表示,它一直致力于完成Exondys的试验工作,但由于受各种因素影响(包括FDA提出的一些要求),试验工作有所延迟。该公司针对另外两只药物的验证性试验正在进行中,预计将于2025年完成。
新法施压研究
制药公司被要求开展额外的试验工作,以证明药物在获得加速批准后是有效的,但直到近年来,它们在快速开展这种试验工作上并无太多的紧迫感。
为了改变这种情况,美国国会去年12月通过了一项法律,规定FDA可以要求制药公司在获得加速批准时进行验证性研究,并详细说明了FDA可以用来撤销加速批准的程序。FDA局长Robert Califf今年1月曾经表示:“国会给了我们很大的权限。”
但是,并不是所有人对此都持肯定态度。哈佛大学医学院医生Thomas Hwang表示,新法律有待进一步解释,它并没有消除制药公司延迟开展试验的可能性。加拿大皇后大学肿瘤系的Bishal Gyawali表示,“在试验遭遇失败之后,FDA无法立即强制加速批准的药物退出市场”。
与此同时,依旧有患者每天都在使用不符合FDA常规批准标准的药物。美国卫生与公众服务部(HHS)监察长办公室(OIG)报告,2018-2021年期间,联邦医疗保险(Medicare)和医疗补助(Medicaid)计划在那些验证性试验最终被推迟的加速获批药物上花费了180多亿美元。
大刀阔斧撤回
由于对这种批准途径的争议越来越大,当所需进行的验证性试验没有完成,或者未能证明药物有效时,FDA正在尽更大的努力,让这些药物退出市场。根据彭博新闻社所做的分析,2022年有7只药物失去了加速批准资格,与2021年持平,是有史以来最多的一个年份。撤回行动由制药公司自愿进行,往往是在FDA的要求之下。
过去三十年来,约有300项新药申请采用了加速审批程序,主要针对的是抗癌药物。在某些年份,超过20%的上市新药来自于这一审批途径。不过,2022年,这一比例仅为12%,比2021年和2020年大幅下降。
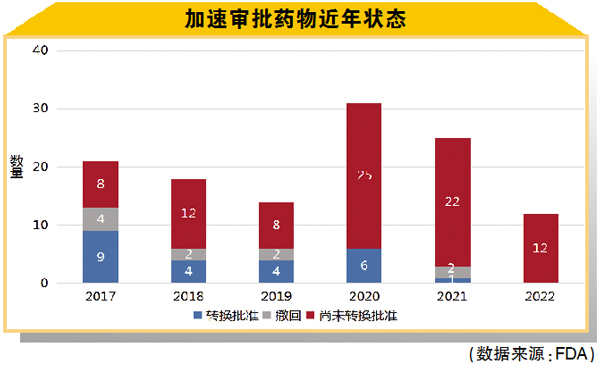
近几年,获得加速批准的药物状态如图所示,考虑到开展研究所需的时间,最近几年出现的转换批准数量较少无可厚非。或许随着FDA对验证性试验的更严格要求,或许随着该机构迅速采取行动,撤回不合格的药物,未来几年撤回的数量也会增加。
其他国家也针对新药制定了快速审批机制。而根据FDA官员在2022年所做的一项调查,在除日本和加拿大以外的大多数国家,这种简捷的批准路径都设置了有效期。欧盟建立了一个快速审批通道,不过,每次只允许一只药物上市一年,以鼓励制药公司更快地提供治疗药物有效的数据。
两难境地破局
与此同时,我们依旧记得有些显著的医学进步是通过加速审批路径实现的,比如诺华公司的白血病治疗药物格列卫(Gleevec,伊马替尼)。加速批准也扩大了一些重磅炸弹级癌症免疫疗法的应用范围,比如默沙东的Keytruda和百时美施贵宝(BMS)的竞争性药物Opdivo。
默沙东和BMS开发的这些药物用于许多种癌症时都有效,并且得到了很好的证明。但即便如此,这些药物针对某些癌症获得的一些加速批准后来也被撤销了。
近年来,加速审批路径的使用已经扩展到更有争议的治疗领域,比如阿尔茨海默病,广大医生对扫描检查或者实验室测试是否能够可靠地预测药物有效存在分歧。渤健的阿尔茨海默病治疗药物Aduhelm可能就是一个最好的例子。该公司开展的两项大型试验产生了相互矛盾的结果——一项研究表明该药有效,另一项则没有。2020年11月,FDA的一个顾问小组投票反对通过传统审批路径批准该药。但是,仅仅7个月之后,在患者利益保护团体的施压下,FDA决定使用加速审批路径来批准该药,这是一个不同寻常的举动。FDA给予渤健8年多的时间开展第三次大型试验,目前,这项试验正在进行之中。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






