缺钱!第九款PD-1/L1“难产”
发布时间:2023-05-04 11:18:00作者:陈昕朦 综合编译来源:医药经济报
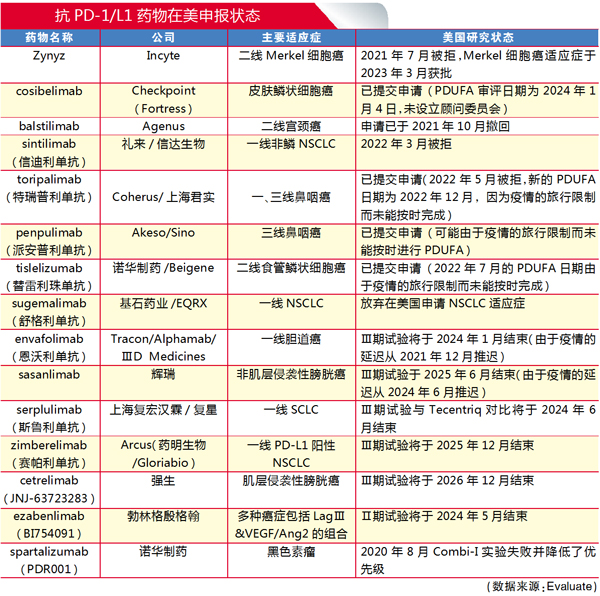
3月22日,Incyte公司的Zynzy(retifanlimab-dlwr)获批用于治疗成人转移性或复发性局部晚期默克尔细胞癌(MCC),成为第八个进入美国市场的抗PD-1/L1单抗,但投资者对此反响平平。这不由让人联想到3月初上市申请获得FDA受理的另一个抗PD-L1抗体cosibelimab,其PDUFA的目标日期设定为2024年1月3日,虽然其有望成为下一个获得绿灯通行的抗PD-L1抗体,但其开发商Checkpoint Therapeutics已经面临财务破产的风险。
开发商囊中羞涩
Checkpoint Therapeutics是一家市值为4500万美元的微型企业,对该公司而言,找到愿意出资推出cosibelimab许可证持有人是首要任务。
cosibelimab已提交申请用于治疗皮肤鳞状细胞癌(CSCC),由于没有计划召开医学咨询会议,这个审查应该不会有太大的争议。Checkpoint的首席执行官詹姆斯·奥利维罗表示,计划在美国推出这种药物,或者可能与外部合作,并以折扣的价格出售该药。
乐观的背后,Checkpoint面临一个不容忽视的问题,其大部分所有权归Fortress Biotech所有,2022年年底公司只结存1200万美元现金,尽管最近筹集了600万美元,但在去年“烧掉”的4300万美元面前,还是很难维系。其年度SEC申报文件指出:“我们有很大的疑虑是否能够继续作为一个运转正常的公司。目前的现金不足以维持至下一个12个月的运营。”
待审药优势明显
在忽略Checkpoint财务问题的情况下,cosibelimab确有一些过人之处。它是一个完全人源化的单抗,可以与NK细胞以及T细胞结合。
此外,cosibelimab是一种抗PD-L1药物,相对于现有药物,其免疫系统介导的毒性更低。目前获批用于CSCC的两种抗检查点抑制剂——Keytruda和Libtayo均以PD-1为靶点。
奥利维罗表示,尽管转移性CSCC市场拥有11000名美国患者,但因为免疫抑制,仍有60%的患者在接受化疗,cosibelimab的PD-L1机制使这些患者成为潜在治疗候选人。但cosibelimab尚未在免疫抑制的CSCC患者中进行过研究。
虽然Keytruda和Libtayo已获得全面批准,但Checkpoint有信心使用总体反应率数据(47%)获得通过,这是其单组试验的数据。该公司曾经宣称,根据研究者的评估,ORR为51%,但在中央审查后逐渐减少,现在与Libtayo在跨试验基础上大致相当。
或采取折扣销售
此前,曾有多个药物试图依靠价格优势对Keytruda形成威胁,大多以失败告终,但Checkpoint仍然认为这是一个值得尝试的方法,该公司表示会寻找利用定价夺取市场份额的机会。
然而,相比于两年前,Checkpoint已经有所退缩。两年前,根据投资者介绍,Checkpoint曾透露会比同行减价20%~30%,但如今,该公司则表示该折扣是在cosibelimab生成“最佳数据”之前的计划,现在不太可能以该折扣销售。
虽然CSCC只是cosibelimab的近期适应症,但在Clinicaltrials.gov数据库没有发现该药物正在进行的其他研究。
【小结】 由于潜在的财务困境,Checkpoint的处境尴尬,但业界仍希望无论是Checkpoint继续坚持还是其他人接掌局面,患者都能拥有更多的用药选择。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






