Biotech“组团”掘金东南亚
发布时间:2023-05-04 10:48:23作者:杨泽康来源:医药经济报
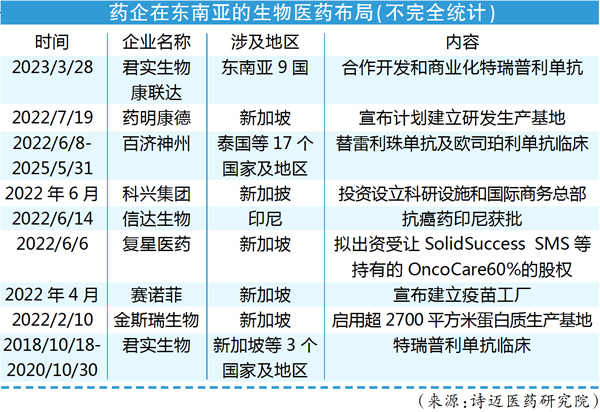
近日,君实生物与康哲药业子公司将设立合资公司,在东南亚九国对PD-1药物特瑞普利单抗进行合作开发和商业化。
重视东南亚市场的不止君实生物,德琪医药早在多年前就从新基公司获得ATG-010和ATG-008在东亚和东南亚多个国家的开发权。
事实上,从2022年开始,国内药企在东南亚地区布局动作频繁,包括建立基地、推进药品二次商业化、建立当地合资公司等。
国内Biotech频繁尝试探索欧美以外海外市场的背后,是国内头部Biotech对国际化理解的逐渐顿悟。
看好区域增势
伴随东南亚区域经济快速增长,人均寿命和人均可支配收入大幅提高,人口老龄化及非传染性疾病负担加重,导致该区域医药卫生费用支出持续快速增长,到2020年已突破400亿美元,成为全球发展速度最快的医药市场之一。亚洲医疗保健资产管理公司CBC Group此前发布报告认为,到2030年,东南亚的医疗保健支出预计将增加至约2700亿美元。
东南亚国家中,新加坡凭借完整的产业链体系、高度受国际认同的监管标准以及发达的贸易网络,吸引了众多医药巨头布局,成为东南亚地区创新药产业当之无愧的领跑者;泰国、马来西亚、印尼等国近年来在政府的大力推动下,医疗产业发展环境不断改善,也实现了较快发展。
在各国带动下,东南亚地区创新药产业发展持续提速,临床研发能力迅速提升。根据Informa数据,2018-2022年,东南亚地区每年新增临床试验数量400个以上,年复合增长率1.9%。其中,4年间泰国临床试验数量达到886个,位居地区首位;新加坡和马来西亚分别为581个和475个;菲律宾、印尼和越南位居第三梯队,临床试验数量分别达到270个、228个和207个。
创新药企沃土
相对较低的药品注册门槛,以及成员国之间相对快捷的药品流通机制,也是东南亚创新药市场备受看好的重要因素之一。
虽然东南亚目前还没有形成类似欧盟的通用药品注册机制,东盟各个成员国之间也没有明确的互认机制,但为加快区域内药物流通,东盟成员国之间已展开了越来越多的区域合作,比如关于药品生产企业GMP检查的多部门互认协议(MRA)。
药品注册方面,目前东盟所有国家在药品注册过程中都可接受外国临床数据,一般不再需要提交基于本地患者的临床数据,也无须对标欧美获批资格。这对国内创新药企业而言,无疑是更具潜力的海外市场。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






