一季度国家药监局批准的新药看点
发布时间:2023-04-12 10:51:14作者:本报研究策划中心 陈雪薇来源:医药经济报
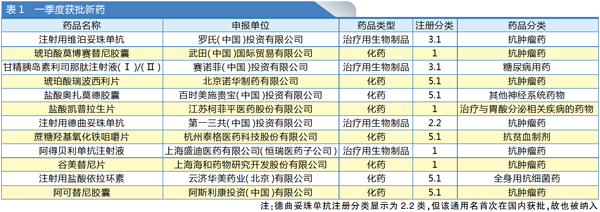
据国家药监局已披露信息,2023年一季度,国家药监局共批准了12个新药(仅统计通用名首次在国内上市的药品,不包括改良型新药与新冠疫苗/药品),包括8个化药、4个生物制品。其中既有创新企业商业化上市的首个产品,如云顶新耀的依拉环素,也有传统巨头产品群“新兵”,如恒瑞医药获批的第12个创新药阿得贝利单抗。此外,罗氏、诺华、百时美施贵宝等7家外企也有所斩获。
值得一提的是,阿得贝利单抗是国内获批上市的第16个PD-1/L1抗体药物,如何在“红海”里游出一片天,是恒瑞医药面临的一个考验。云顶新耀同样如此,如何实现从临床到市场的华丽转身,是创新药企的必闯关。
1.ADC赛道热度升温
抗肿瘤药是一季度获批药品中的绝对主力,共有7个。此外,消化系统及代谢药有2个产品,抗感染、神经系统药物与血液和造血系统药物各有1个产品(见表1)。
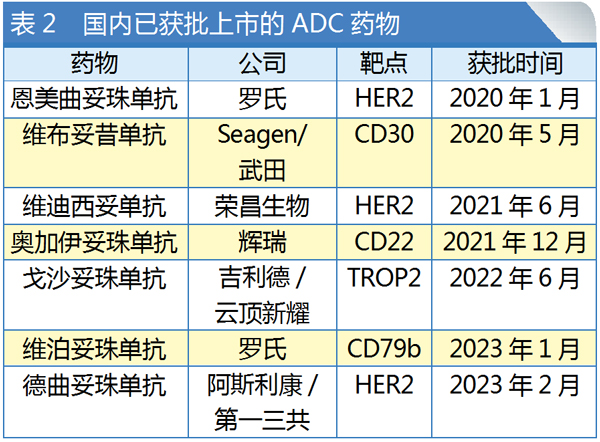
而在抗肿瘤药物中,ADC药物又分外抢眼,1个多月内就有两个产品陆续获批。这2个ADC药物均为进口产品,分别是罗氏的维泊妥珠单抗(Polivy)与第一三共的德曲妥珠单抗(Enhertu)。至此,国内获批上市的ADC药物已达到7款(见表2)。
研发管线提速
作为创新药领域的热门赛道,目前全球共有16款ADC药物获批上市。
PharmSnap数据显示,目前国内还有1款ADC处于上市申报阶段。进入Ⅲ期临床的候选药物更是多达15个,预计将迎来ADC药物的爆发期。
具体来看,德曲妥珠单抗所针对的HER2是ADC药物最热门的靶点,在研发管线中的占比高达38.4%。此外,EGFR、TROP2、CLDN18.2、c-Met也是国内外研发项目较多的靶点。
国内药企中HER2 ADC进展最快的是荣昌生物的RC48,其胃癌和尿路上皮癌适应症已获批。此外,恒瑞医药、东曜药业以及浙江医药新码生物的HER2 ADC均处于Ⅲ期临床阶段。
维泊妥珠单抗则是国内首款CD79b ADC药物,与火爆的HER2不同,该靶点研发线目前并不拥挤,全球处于临床阶段的CD79b ADC共3款,其中获批上市1款,Ⅰ期临床2款。国内处于临床阶段的CD79b ADC共2款,其中获批上市1款,Ⅰ期临床1款。
多款药物“出海”
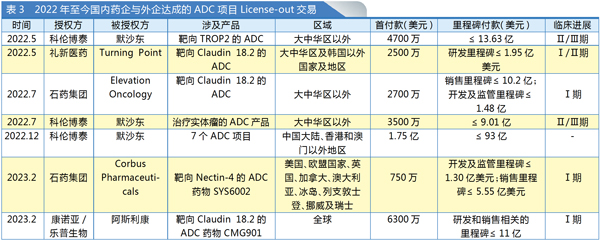
与研发上市火热程度并行的,还有国内ADC产品的“出海”热度。尽管我国ADC药物起步较晚,但科伦药业、石药集团、乐普生物、恒瑞医药等近年来取得了快速进展,在部分技术和疾病领域拔得头筹,一些创新产品在全球崭露头角,受到跨国药企青睐,授权合作逐渐升温。尤其是2022年科伦药业与默沙东达成的3次合作,累计交易总额达118.2亿美元,创下ADC“出海”新高。
今年以来,热度依旧不减。2月份,石药集团、康诺亚/乐普生物分别与Corbus Pharmaceuticals、阿斯利康达成了License-out交易(见表3)。
2.乳腺癌重磅搅动风云
在外企获批上市的新药中,乳腺癌药物德曲妥珠单抗与瑞波西利(Kisqali)可谓“重量级选手”,这两个药物均已跻身“重磅炸弹”(年销售额超过10亿美元),且销售额仍在快速增长。
德曲妥珠单抗一路高歌
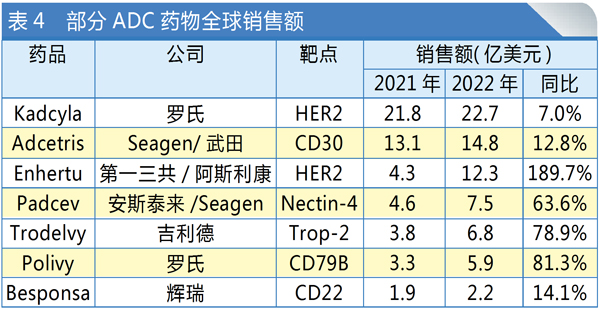
德曲妥珠单抗是第三代ADC药物,于2019年在美国首次获批上市。2022年,该药接连获批HER2低表达乳腺癌和HER2阳性非小细胞肺癌等重磅新适应症,全年销售额达到12.3亿美元,同比增长189.7%,增速远高于其他上市ADC药物,销售额也跃升至全球ADC药物第三位。
随着德曲妥珠单抗在HER2泛瘤种治疗方面取得新的积极临床数据,其有望成为新一代ADC药物龙头。这也将对同处于HER2靶点赛道的其他ADC药物带来压力。例如全球首款重磅ADC药物恩美曲妥珠单抗(Kadcyla),作为2013年上市的第二代ADC药物,该药市场份额一度超过50%,2022年依旧是全球销售额最高的ADC药物,达到22.7亿美元,但同比仅增长7%。
后来者也可能因此心生退意。如国内较早布局ADC领域的东曜药业在今年3月宣布,将终止已处于Ⅲ期临床的HER2 ADC药物TAA013的研发。主要原因是:随着治疗HER2阳性乳腺癌相关的ADC药物市场竞争格局出现显著变化,该公司认为该药在同类赛道产品的市场销售情况和潜在商业价值远低于早前预期。
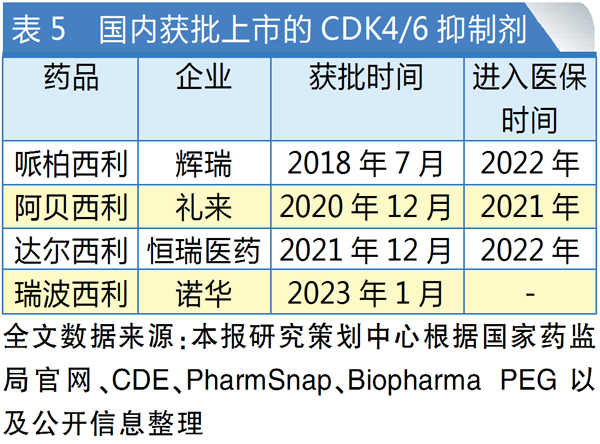
CDK4/6抑制剂后来者逆袭
与德曲妥珠单抗针对HER2+乳腺癌患者不同,CDK4/6抑制剂瑞波西利主要面向HR+/HER2-乳腺癌患者。该药现已成为诺华在实体瘤领域的重要营收支柱之一,得益于良好的总体生存与生活质量获益,2022年瑞波西利销售额增长31%,达12.3亿美元,在CDK4/6抑制剂市场中的占比升至14%。
目前全球共有5款CDK4/6抑制剂上市。从2022年的销售数据来看,哌柏西利(Ibrance)借先发优势仍然占据最大的市场份额(58%),阿贝西利(Verzenio)以28%的占比紧随其后,瑞波西利则首次跨过“重磅炸弹”销售门槛,在CDK4/6抑制剂赛道进一步稳固地位。
目前,国内共有哌柏西利、阿贝西利、瑞波西利、达尔西利4款CDK4/6抑制剂获批上市。与全球市场格局不同的是,国内市场上演了一场后来者的“逆袭”。最早上市的哌柏西利(2018年获批)此前凭借先发优势占领了一定的市场份额并保持稳定,但2022年其CDK4/6抑制剂领军位置被阿贝西利(2020年获批)反超并牢牢占据。主要原因就在于阿贝西利在适应症覆盖上具备优势,且其比哌柏西利早一年进入医保目录。
临床价值为新药参与市场竞争打下基础,而快速的市场准入如进医保,也是推动新药商业化的关键一环。头顶“重磅炸弹”光环,德曲妥珠单抗与瑞波西利究竟会给国内ADC药物与CDK4/6抑制剂市场带来怎样的影响,值得观察。
相关<<<
政策利好催暖中药创新
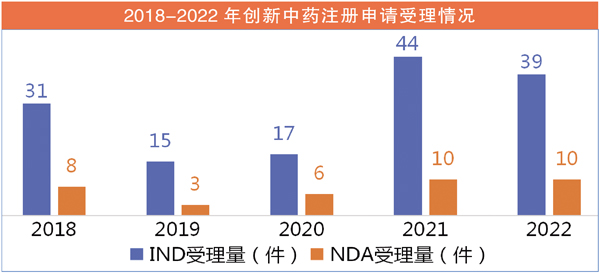
2021年,创新中药上市数量创近几年新高,达12个。2022年则有6个品种获批上市,而2023年第一季度中药新药尚未“开张”。不过,从IND与DNA的申请受理量来看,近两年依旧平稳,波动不大。
在相关政策的助推下,中药新药的研发与审批有望进一步提速。2023年2月,《中药注册管理专门规定》(以下简称《规定》)发布,中药创新路径更加清晰。《规定》不仅强调中药注册审评采用“三结合”(中医药理论、人用经验、临床试验)审评证据体系来进行综合评价,还明确了适合中药的简化注册审批、优先审评审批、特别审批、附条件审批等相应规定。
值得注意的是,多情景可豁免非临床/临床试验。根据《规定》,对于来源于临床实践和医疗机构机制的中药新药,和有充足人用经验证据的中药改良型新药,在特定情形下,可不开展非临床有效性研究和Ⅱ期临床试验,这将大大缩短研发周期,加速商业化进程。
不仅仅是注册审批,中药行业政策利好仍在持续释放,今年一季度还有《关于进一步加强中药科学监管 促进中药传承创新发展的若干措施》《中医药振兴发展重大工程实施方案》等重磅文件出台,在中药科学监管与中医药发展重大工程等方面,作了更细致的规划。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






