新兴生物药上市“自力更生”
发布时间:2023-03-28 11:32:51作者:本报研究策划中心 综合编译来源:医药经济报
新兴生物制药企业(emerging biopharma company,EBP)是全球药品研发的主力军,对研发线的贡献不断提升,每年由其研发上市的新药屡创新高。颇具前景的研发线,往往让EBP企业成为大型药企的“猎物”。但如今越来越多的EBP企业选择“自立更生”,自行提交新药的上市申请。
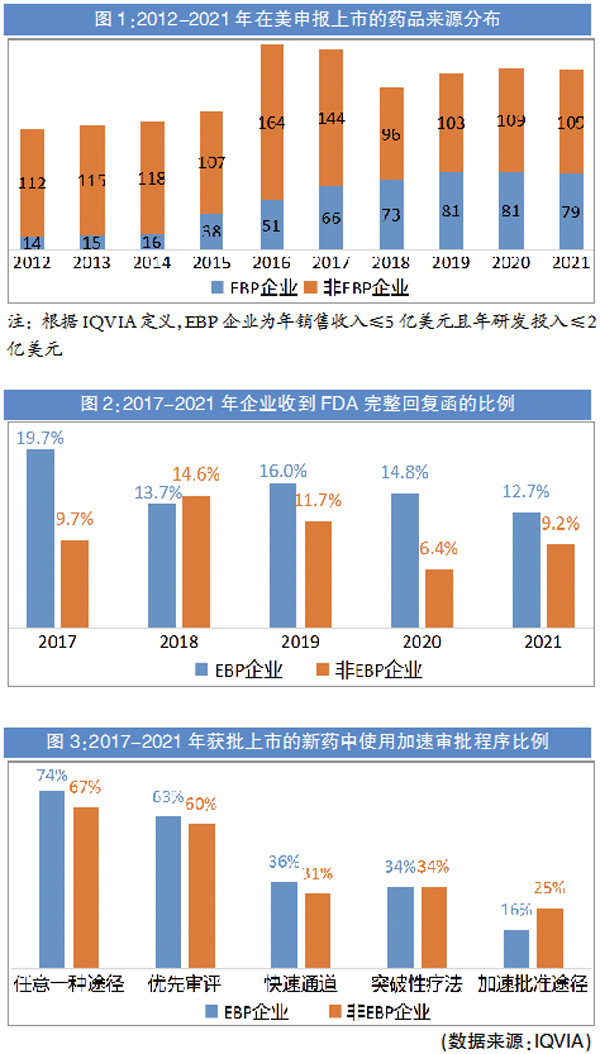
2012-2021年,EBP企业向FDA提交上市申请的数量增长了4倍多。2021年,向FDA提交的上市申请中,来自EBP企业的占42%,2012年时该数值仅为11%。EBP企业产品在FDA上市申请占比提升这一趋势,反映出越来越多的EBP企业独立研发,且独立商业化,而不是与更大型药企开展合作。
不过,EBP企业的上市申请通常会遇到更多的波折。2021年,EBP企业收到完整回复函的比例有12.7%,非EBP企业(包括小型药企、中型药企与大型药企)只有9.2%。EBP企业上市申请的问题严重程度偏高,2017-2021年收到的完整回复函中,EBP企业过半(52%)是临床原因,要求增加临床数据,而非EBP企业这一比例是47%。尽管收到的完整回复函中临床原因占比更高,但EBP企业重新提交上市申请的积极性远高于非EBP企业,因为这些企业在研产品十分有限,放弃会面临更高的风险。
2017-2021年,EBP企业与非EBP企业收到的非临床原因(如生产、产品质量、化学数据等)的完整回复函中,三分之二会在短时间内改正问题并向FDA重新提交上市申请。2020-2021年,许多完整回复函是非临床原因,主要由旅行限制与FDA无法及时开展生产现场检查所致。
成功通关的新药上市速度明显提升。新药从申报首个专利到在美国上市的时长,2016年EBP企业与非EBP企业均约为16年,2021年EBP企业缩短至12.4年,非EBP企业更短,为10.6年。
2012-2021年,有36个新药在申报首个专利后的5年内便成功上市,其中一半来自EBP企业;过去两年,如此快速上市的新药达到20个,也有一半来自EBP企业,如果不是非EBP企业有更多紧急授权使用的新冠产品,EBP企业的占比会更高。
FDA的加速审批程序包括快速通道、突破性疗法、加速批准途径与优先审评。2017-2021年EBP企业上市的新药中,除加速批准外,获得其它3种加速审批程序的比例均不低于非EBP企业。这对于EBP企业或许并非坏事,因为加速批准的新药还需在上市后研究中达到一定的要求。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






