解除非小细胞肺癌耐药魔咒
发布时间:2023-03-14 09:44:53作者:秦卫华(中山大学药学院新药研发中心原常务副主任)来源:医药经济报
第六届国际肿瘤精准医疗大会焦点回放
肿瘤精准医学关注的科学问题一直是创新药研发的基础,而研究肿瘤发生发展的机制为原创新药提供了可能,其中,生物标志物为早期诊疗和靶向治疗提供用药时机,提高了药物有效率并减少副作用;分子分型分期则利于个性化用药和预后判断。前段时间,笔者赴上海参加第六届国际肿瘤精准医疗大会,与会临床专家讨论认为,新药研发还需要与临床医生进行交流互动,特别关注抗肿瘤药物耐药问题。本文以非小细胞肺癌(NSCLC)为例,结合会议内容,探讨精准医学对抗肿瘤创新药研发的助力。
深究机制争取突破
NSCLC占所有新诊断肺癌病例的85%,是最常见的肺癌亚型之一。目前,NSCLC患者的肿瘤驱动基因已被一一揭示,包括表皮生长因子受体(EGFR)、间充质淋巴瘤激酶(ALK)、受体酪氨酸激酶ROS原癌基因1(ROS1)突变体。针对调节NSCLC生长和发展的关键基因介导信号通路的抗体和抑制剂,有望提高患者的存活率和生活质量。
目前,FDA已批准NSCLC靶向药物20多种,化疗和靶向治疗显著改善了患者的预后。然而,癌症驱动基因改变导致的耐药性仍给转移性NSCLC患者的治疗带来了很大挑战,尽管NSCLC的可用疗法已取得很大进展,但获得性耐药性仍然是治疗的主要障碍,与会嘉宾、同济大学肺癌专家周彩存教授指出:“尽管我们对这种疾病的许多致癌驱动因素有了越来越多的了解,但尚未实现治愈晚期NSCLC的能力。”
主要靶点研发进展
目前,新靶点的发现和新药研发进展,使晚期NSCLC生存获益不断突破。从传统组织学划分,KRAS靶点、EGFR靶点,再到更多驱动基因被发现,诸多靶向新药获批或即将获批上市。还有更多新的潜在靶点尚在研究中,如成纤维细胞生长因子受体(FGFR)、FOS相关抗原1(FRA1)、Friend白血病病毒插入位点(FU1)等。
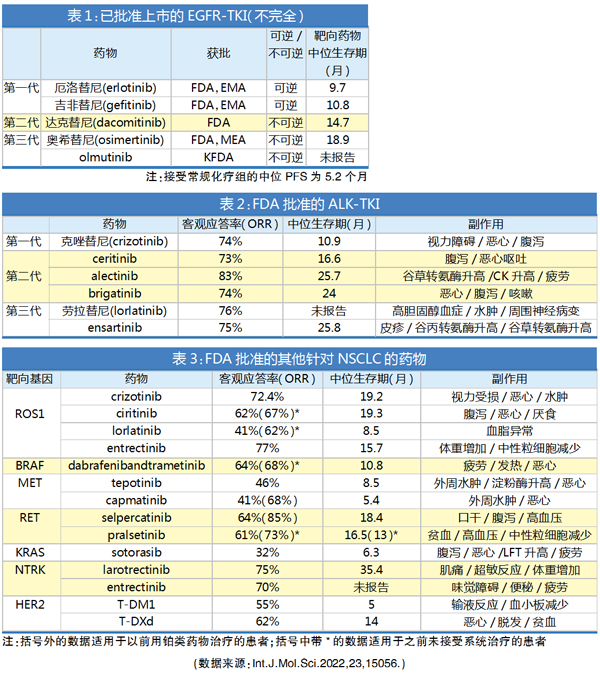
1.EGFR-TKIs:2004年发现有效靶向肺癌患者EGFR突变的酪氨酸激酶抑制剂,标志着这一难治性疾病的精准医学时代的开始。这一巨大进展得益于对驱动基因突变的识别,在NSCLC患者中更多靶向驱动基因突变的识别,极大促进了靶向治疗的发展,并为改善患者预后提供了巨大帮助,包括显著延长生存时间和改善生活质量。由于超过60%的NSCLC表达EGFR,因此它已成为治疗这些恶性肿瘤的重要治疗靶点。目前,已经获批的有三代EGFR-TKI。
第四代EGFR-TKI似乎对EGFR-C797S突变有效,并且在临床前模型中具有很强的抗肿瘤活性。除了TKI,还设计了其他类型的抑制剂,可以改善EGFR突变NSCLC患者的治疗。特别是EGFR降解剂的发现具有很大前景。靶向蛋白质降解的一个关键焦点是蛋白水解靶向嵌合体(PROTAC)的开发。
尽管EGFR-TKI的反应率很高,但获得性耐药几乎总是会发生。有几种机制与耐药细胞耐受EGFR-TKI有关,包括染色质重塑、旁路通路激活和细胞代谢改变。
2.ALK-TKIs:ALK基因编码酪氨酸激酶受体位于2号染色体短臂(2p23),属于胰岛素受体超家族,编码ALK蛋白。在2%~7%的NSCLC患者中可检测到间变性淋巴瘤激酶(ALK)基因的致癌融合,这些患者通常不吸烟并显示腺癌组织学。大多数携带ALK重排的NSCLC病例从ALK酪氨酸激酶抑制剂(ALK-TKI)中获得临床益处。然而,尽管序贯ALK-TKI实现了81个月的中位总生存期(OS)的长期缓解,但耐药性不可避免地以其他主导形式出现。
上皮-间质转化(EMT)是一种细胞可塑性程序,可以赋予癌细胞侵袭性、传播性和治疗抗性。有报道称,一种新的治疗策略,联用水飞蓟宾能够减少EMT驱动因子TGFβ的过度分泌,可以预防或逆转由EMT现象引起的对ALK-TKI的耐药性。
正视耐药共性问题
耐药已经成为靶向药物长期疗效的瓶颈,是未满足的临床刚性需求,是研发抗肿瘤药物的挑战与机遇。专注解决耐药问题的创新药,可提高原创性和避免高水平重复。
1.基因多靶点突变:由于早期进入临床、针对NSCLC驱动基因的靶向药物多是单靶点,而肿瘤的发生发展有可能存在多靶点突变,既可能是原发的,也可能是继发的。例如,大约50%的BRAF突变是BRAF(V600E),其他典型的BRAF突变是BRAF(D594G)和BRAF(G469A/V)突变,它们分别存在于35%和6%的BRAF突变NSCLC患者中。尽管BRAF(V600)基因靶向药物vemurafenib和dabrafenib作为单一疗法在临床上是有效的,但添加MEK抑制剂可进一步提高疗效,BRAF抑制剂和MEK抑制剂的组合优于单一药物,将ORR率提升至67%,将中位PFS提高到10.2个月。然而,大多数NSCLC患者将在开始BRAF和MEK抑制作为治疗策略后的一年内产生耐药并发生疾病进展。
2.多信号通路:多信号通路使肿瘤细胞增殖和转移绕开了靶点抑制剂。根据临床前和临床数据,除BRAF突变外,耐药机制还包括旁路通路的激活、PI3/AKT/mTOR,以及由于上游或下游变化而对抑制无效的MAPK信号的恢复,MAPK通路信号的重新激活介导获得性BRAFi抗性的机制已经开始出现。据报道,PDGFR、EGRF等RTKs的过表达或上调是导致RAF抑制剂耐药的一个修饰。由于这些修饰会刺激RAS并激活CRAF-MEK-ERK信号,因此癌细胞的增殖不依赖于BRAF(V600E)。RAS突变的功能类似于RTK改变,被确定为导致RAF抑制剂耐药性的RTK下游的第二个因素。一旦癌细胞有大量活性Ras,载药BRAF(V600E)就会与CRAF二聚化,激活其催化活性,这被称为RAF抑制剂的矛盾效应。因此,BRAFi的下代产品研发仍在进行中。
3.影响药物局部有效浓度的生物利用度:CRAF激酶表达是耐药机制之一。根据这项研究,具有大量CRAF蛋白的突变细胞可能会降低药物的生物利用度。此外,BRAF突变癌细胞的亚群可能会发展成对主要抑制剂CRAF蛋白水平升高具有抗性。因此,探索造成耐药产生的深层原因,寻找耐药的共性,有可能突破耐药瓶颈,解除靶向药物耐药魔咒,造福更多肿瘤患者。
4.代谢重编程:重塑细胞代谢,包括在营养缺乏条件和其他压力下维持氧化还原平衡的能力,是癌症的标志之一。与主要依赖线粒体氧化磷酸化(OXPHOS)产生ATP供能的正常细胞相比,癌细胞通常依赖有氧糖酵解。这种现象也称为Warburg效应,代表了在癌细胞中观察到的代谢重编程的最常见特征。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






