优势渐显 热点解构
发布时间:2023-03-01 14:13:18作者:特约撰稿 李彬 李岚岚 作者单位:国家药监局药品审评检查大湾区分中心来源:医药经济报
粤港澳大湾区改良型新药近五年研发现状
在国家鼓励创新的大环境下,改良型新药备受瞩目。相对于创新药,改良型新药具有研发成本低、耗时短、高回报的优势。随着相关政策和法规的实施和完善,粤港澳大湾区改良型新药的注册申报量快速提升。
笔者对2018-2022年粤港澳大湾区化学药品和生物制品改良型新药注册申报情况进行汇总,并分析与总结近年来的研发现状。
随着国家药品注册制度改革与优化政策引导,粤港澳大湾区药企越来越重视在改良型新药领域的注册申请研发和生产工作。2022年,改良型新药上市申请开始提速,其研发周期短的特点逐渐显现。相比较而言,化学药品改良型新药的研发和注册申报较生物制品行业火热(详见本报2023年2月27日刊1版《大湾区改良型新药注册扫描》)。
本文聚焦于粤港澳大湾区改良型新药的剂型、适应症、企业分布和生物制品等情况。
生物制品:治疗用2.2类受青睐
根据2020年7月1日起实施的《生物制品注册分类及申报资料要求》,生物制品改良型新药分为预防用和治疗用两大类型。其中,预防用生物制品2类产品有6种类型,治疗用生物制品2类产品有4种类型。
对于治疗用生物制品,2.1类指在已上市制品基础上,对其剂型、给药途径等进行优化,且具有明显临床优势的生物制品。2.2类指增加境内外均未获批的新适应症和/或改变用药人群。2.3类指已有同类制品上市的生物制品组成新的复方制品。2.4类指在已上市制品基础上,具有重大技术改进的生物制品,如重组技术替代生物组织提取技术;较已上市制品改变氨基酸位点或表达系统、宿主细胞后具有明显临床优势等。
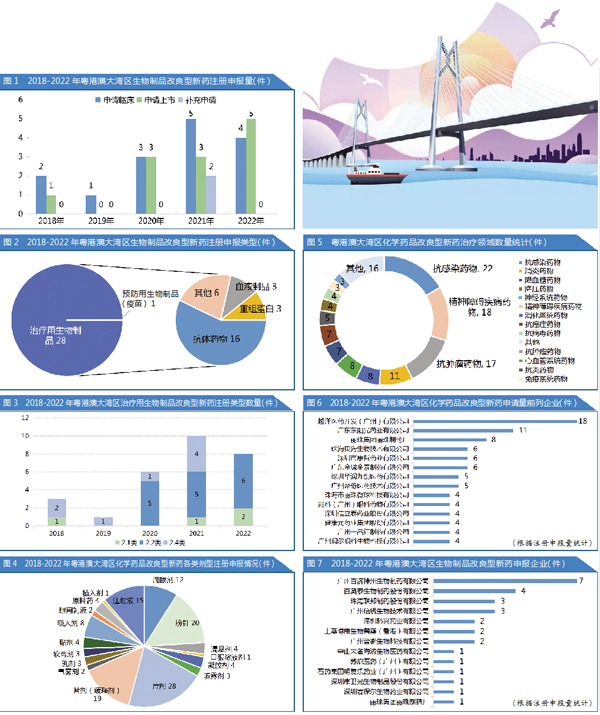
2018-2022年粤港澳大湾区生物制品改良型新药注册申报量见图1,近三年的临床试验申请分别为3件、5件和4件,近3年的上市申请分别为3件、3件和5件。
近五年中,仅1家公司申报预防用生物制品2类新药,为深圳市卫光生物制品股份有限公司申报的冻干人用狂犬病疫苗(鸡胚细胞);其余受理的28件均为治疗用生物制品改良型新药。治疗用生物制品改良型新药治疗领域主要是抗体药物,其中,2.2类占75%,2.4类占25%(图2)。
数据显示,近五年粤港澳大湾区生物制品改良型新药注册申报,2.2类仍是主流趋势,近三年的注册申报量分别为5件、5件和6件。而在注册申报中,尚未有企业涉足2.3类复方制品领域。由此可见,各大药企更热衷于开发新适应症或改变用药人群(图3)。
此外,2.4类生物制品改良型新药主要集中在肿瘤领域,随着研究的深入和临床使用,当发现药物对其他适应症也有效的时候,企业会选择新增适应症申报。目前,粤港澳大湾区申报2.4类生物制品改良型新药的企业主要为百奥泰生物制药股份有限公司。
剂型:片剂、粉针、注射液为主
以粤港澳大湾区化学药品改良新药为例,2018-2022年企业申报的剂型以常见的片剂(包括缓释剂)、粉针以及注射液为主,申报数量分别为47件、20件和15件,滴眼剂申报数量也较多(12件),吸入剂、凝胶剂、喷雾剂、贴剂等剂型品种数量则较少(图4)。
适应症:精神障碍类占比最大
粤港澳大湾区化学药品改良型新药治疗领域主要集中在抗感染、抗肿瘤和精神障碍类疾病(图5)。
其中,抗感染药物占比最大,主要针对洛索洛芬钠、帕拉米韦做制剂改良的较多;其次是精神障碍类疾病药物,主要为2.2类。
再次分别是消炎药物、消化系统药物、心血管系统药物和降血糖药物等。
企业:内地九地市申报活跃
据统计,2018-2022年粤港澳大湾区共有57家药企开展了改良型新药的注册申请研发和生产,其中,化学药品生产企业44家,生物制品生产企业13家。
改良型新药的注册申报主要集中在内地九地市,香港和澳门地区的药企在国内申报的活跃度相对较低。其中,越洋医药、东阳光药业、丽珠集团、广州百济神州、百奥泰等实力较强的企业在该领域卓有建树;作为香港地区的企业代表,極目生物有限公司、亚虹医药科技(香港)有限公司、上藥博康生物醫藥(香港)有限公司也积极加入改良型新药赛道开展注册申报。
相关<<<
新政助力重塑转型赛道
新法规的发布与实施,重新构建了医药企业的转型赛道。
对比创新药的高研发难度,改良型新药具有高性价比的优势,已逐渐成为新药研发的另一发力点。
总领性文件为基石
在政策和法规层面,《总局关于发布化学药品注册分类改革工作方案的公告(2016年第51号)》《国家药监局关于发布生物制品注册分类及申报资料要求的通告(2020年第43号)》《国家药监局关于发布化学药品注册分类及申报资料要求的通告(2020年第44号)》是改良型新药的总领性文件。
指导原则不断完善
此外,国内也制定和出台了关于改良型新药的临床技术指导原则,包括2020年颁布的《化学药品改良型新药临床试验技术指导原则》、2022年颁布的《改良型新药调释制剂临床药代动力学研究技术指导原则》;非临床方面,2017年CDE审评团队在《中国新药杂志》发表了《改良型新药非临床研究的一般考虑及需要关注的问题》,为业界提供参考。
随着科学试验的进展,相关内容也将不断完善与更新。
儿药研发添加动能
对于儿童改良型新药,2021年9月3日国家药品监督管理局药品审评中心发布的《儿童用化学药品改良型新药临床试验技术指导原则(试行)》,鼓励药物研发者研发适宜儿童使用的剂型和规格。
2022年5月9日,国家药品监督管理局发布的《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》第28条指出,国家鼓励儿童用药品的研制和创新,支持药品上市许可持有人开发符合儿童生理特征的儿童用药品新品种、新剂型、新规格,对儿童用药品予以优先审评审批,并引入市场独占期政策。这为改良型新药研发中侧重儿童用药品新剂型的开发提供了更强动力。
小结<<<
当前,在国家鼓励创新的大环境下,改良型新药通过对原有药物进行再次创新,相比于创新药,其具有研发成本低、耗时短、高回报的优势。
在粤港澳大湾区,改良型新药的注册申报主要集中在内地九地市,改剂型、适用新适应症及改变用药人群仍然是各大药企在改良型新药赛道的主攻方向。
随着粤港澳大湾区医药行业基础的不断夯实,通过机制创新和制度创新,粤港澳大湾区的改良型新药研发将进入快车道,对推动大湾区医药产业高质量融合发展、助力实现“健康中国”具有重要意义。
《大湾区改良型新药注册扫描》扫二维码阅读

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






