资源群聚共绘罕见病疗愈之路
发布时间:2023-02-27 10:31:42作者:李勇来源:医药经济报
近年来,罕见病研究(如临床前模型、遗传学、病理学、生物标志物、成像和临床研究等)日益深入,基因疗法等新技术广泛应用,罕见病治疗领域正在经历翻天覆地的变化。每年2月的最后一天是“国际罕见病日”,今年的主题是“分享你的生命色彩”,在罕见病日来临之际,我们共同探寻孤儿药的研发动态与趋势。
连续三年占比过半
业界长期以来将世界罕见病的数量定为7000种左右,然而,近20年来随着生命科学行业对罕见病研究的深入,每年有近300种新的罕见遗传疾病被发现。因此,非营利组织Rare-X基金会于2022年发布的一项分析报告称,目前全球罕见病多达10867种,而且这一数字还在持续快速增长。
对罕见病的研究迅速促进相关药物(孤儿药)开发浪潮的到来。
据美国药品研究与制造企业协会(PhRMA)发布的报告,目前生物制药行业正在开发的(临床试验阶段或等待FDA审查)罕见病药物有近800种。其中有168种罕见癌症和120种罕见血液癌症药物,合计占36%(分别为21%和15%),罕见遗传疾病药物也达到192种,占比24%。
生物制药企业的研发热情正在把越来越多的罕见病药物推向市场。据笔者统计,近10年(2013-2022年)来,美国FDA药物评价与研究中心(CDER)共批准428款新药,其中罕见病药物数量为207款,占比达到48%。而且,近年来FDA批准罕见病药物比例呈现持续增长趋势,连续3年批准罕见病药物比例超过50%。
展望未来,罕见病药物仍将是生物制药行业快速增长的细分领域。据GlobalData预测,2023年FDA将做出至少35项罕见病药物监管决定。
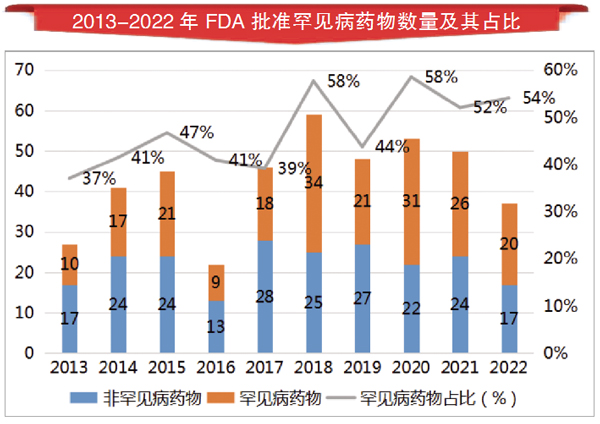
新批药物高歌猛进
在2023年等待FDA批准的罕见病药物名单中,多款药物的新药上市申请/生物制品许可申请(NDA/BLA)或者新增适应症上市许可申请补充申请(sNDA/sBLA)已被FDA受理,而且FDA已明确指定《处方药使用者费用法案(PDUFA)》日期。
2023年截至2月20日,已有3款罕见病新药获得批准:
1月27日礼来的Jaypirca(pirtobrutinib)获批用于治疗至少两种系统治疗[包括布鲁顿酪氨酸激酶(BTK)抑制剂]后复发或难治性套细胞淋巴瘤(MCL)的成年患者,是FDA批准的首款非共价(可逆)BTK抑制剂。
2月16日,Chiesi Global Rare Diseases的Lamzede(velmanase alfa-tycv)获批用于治疗α-甘露糖苷贮积症(AM)成人和儿童患者的非中枢神经系统表现,成为FDA批准的首款治疗该疾病的酶替代疗法。
2月17日,Travere Therapeutics的Filspari(sparsentan)获批用于在有高风险出现疾病进展的IgA肾病患者中降低蛋白尿,是FDA批准治疗IgA肾病的首款非免疫抑制疗法。
与此同时,有多款药物通过补充上市申请获得批准:1月19日FDA批准了百济神州BTK抑制剂Brukinsa(zanubrutinib,泽布替尼)用于成年慢性淋巴细胞白血病(CLL)或小淋巴细胞白血病(SLL)患者;2月8日,再生元的Eylea(aflibercept,阿柏西普)获得FDA批准用于治疗早产儿视网膜病变(ROP),是FDA批准该适应症的首款治疗药物。此外,Seagen、赛诺菲、武田都有罕见病药物获得新适应症/患者群的批准。
也有2款罕见病药物的上市申请遭遇了推迟或者拒绝:1月9日,Krystal Biotech宣布,FDA在收到其于2022年12月20日提交的制造信息文件后,决定将B-VEC用于治疗营养不良性大疱性表皮松解症的BLA的PDUFA日期推迟至2023年5月19日;2月14日,Soligenix公司宣布,已收到FDA关于其合成金丝桃素光动力疗法HyBryte(synthetic hypericin)治疗早期皮肤T细胞淋巴瘤(CTCL)新药申请(NDA)的拒绝提交(RTF)信。FDA初步审查后,认定该公司于2022年12月14日提交的NDA不够完整,无法进行实质性审查。
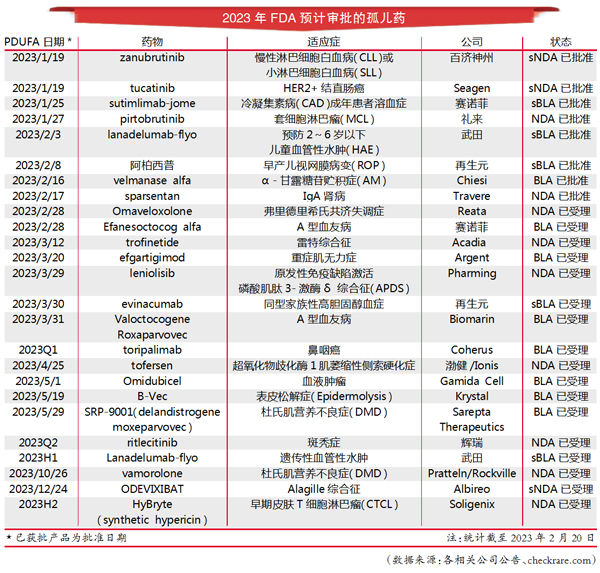
更多突破值得期待
随着对罕见病的深入研究和新技术的应用,未来将会有更多罕见病的新疗法问世。
例如,在杜氏肌营养不良症(DMD)疾病领域,尽管目前已有4种外显子跳跃疗法获得FDA批准,但4款产品加起来仅能治疗近30%的DMD患者。当基因疗法在遗传疾病中越来越受到关注,开发靶向DMD等单基因疾病的潜在病因基因疗法已成为生物制药行业追逐的新领地。今年有望迎来首款DMD基因疗法。
有消息披露称,Sarepta Therapeutics公司的DMD基因疗法delandistrogene moxeparvovic(SRP 9001)PDUFA日期为2023年5月29日。医学界专家认为,如果该药物获得批准,新生儿DMD筛查可能会获得批准,这意味着将允许患者在早期阶段接受治疗。
与此同时,也有企业在寻找DMD传统疗法的替代者。Santhera公司的新疗法vamorolone与糖皮质激素结合相同的受体,但改变了受体的下游活性,潜在地避免了糖皮质激素的副作用。糖皮质激素是目前DMD儿童和青少年患者标准疗法。vamorolone可能成为现有糖皮质激素药物的替代方法。
又如,雷特综合征(Rett syndrome)是一种严重罕见的神经发育障碍疾病。Acadia公司开发的trofinetide,可以改善导致雷特综合征的MECP2基因突变导致的突触和神经元发育不全,其PDUFA日期为2023年3月12日。如果获得批准,trofinetide将成为首款进入美国市场的雷特综合征治疗药物。
再者,肌萎缩侧索硬化症(ALS)被认为是最有望获得成功治疗的神经退行性疾病。尽管ALS领域已有疾病修饰疗法获得批准,但该领域的研究同样热度不减。据悉,目前已经确定了40多个活跃的临床项目,其中使用反义寡核苷酸(ASO)方法的基因疗法也主导了针对特定ALS基因的临床空间。渤健的tofersen为超氧化物歧化酶1(SOD1)突变所致ALS的治疗提供一种新选择。SOD1 ALS是由SOD1基因突变引起的,该疾病占家族性ALS病例的58.9%。tofersen的PDUFA日期为2023年4月25日。
近年来,随着罕见病药物研发热情和批准数量的持续增长,罕见病领域发生了重大的制药收购案件。从2021年阿斯利康大手笔收购Alexion到近期安进收购Horizon Therapeutics和益普生收购Albireo Pharma,充分显示出大型制药公司对罕见病领域投资的兴趣浓厚。
结语<<<
从传统标准的改变到突破式创新,罕见病新药开发正在以前所未有的速度重新激活,进而推动更多新疗法以满足临床未满足的需求,同时也在改变着生物制药行业未来的投资朝向和发展格局。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






