潜力“重磅炸弹”突破性加码
发布时间:2023-01-17 21:20:26作者:本报研究策划中心来源:医药经济报
2022年FDA批准新药三大看点
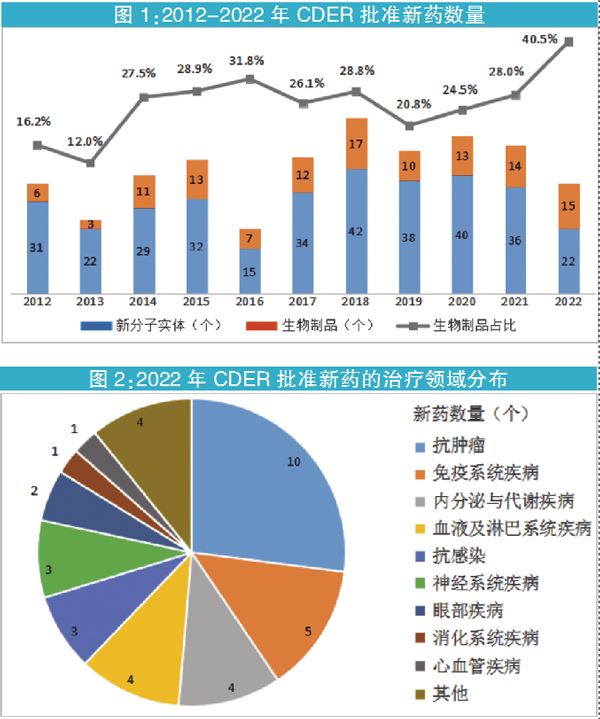
2022年,FDA药品审评和研究中心(CDER)共批准了37个新药,包括22个新分子实体(批准类别为NDA)与15个生物制品(批准类别为BLA)(见图1)。其中,BLA占比达40.5%,创下新高。此外,超过一半获批新药(20个)被授予孤儿药资格。
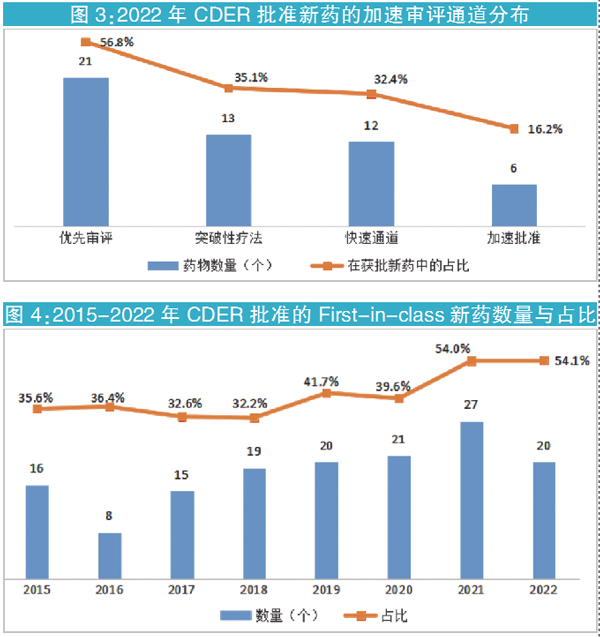
从治疗领域看,依旧是抗肿瘤药最多,共有10个,占比为27.0%;其次是免疫系统疾病用药,有5个(见图2)。
尽管CDER2022年批准的新药数量显著低于近十年的均值(43个),并且是自2017年以来的最低值,但仍有不少看点值得关注。
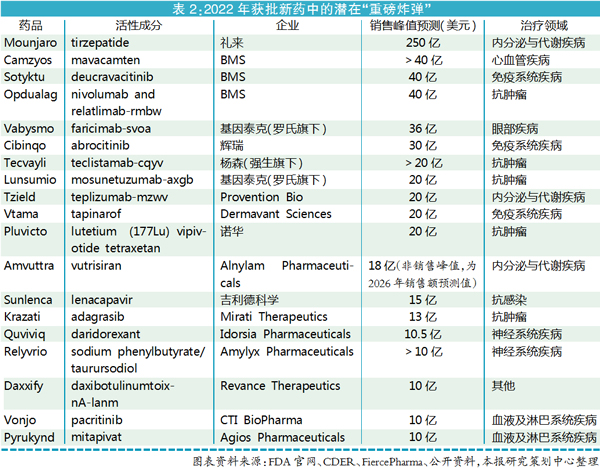
上市通道:超六成新药获加速审评
FDA的加速审评通道是推动新药上市的重要一环。目前有四种路径,包括加速批准(accelerated approval,AA)、突破性疗法(breakthrough therapy,BT)、快速通道(fast track,FT)和优先审评(priority review,PR)(见图3)。
CDER报告显示,2022年获批的37个新药中超过六成(24个)获得了一种或以上的加速审评资格。其中5个药物拥有一个加速通道,11个药物拥有两个加速通道,7个药物拥有三个加速通道,FGFR靶向药Lytgobi把四个加速通道全部拿下,其余14个药物则未获得任何一种加速审评资格。
从加速审评路径来看,获得优先审评的药物最多,达21个;加速批准的药物最少,仅有6个;获得突破性疗法认定与快速通道的药物分别为13个、12个。
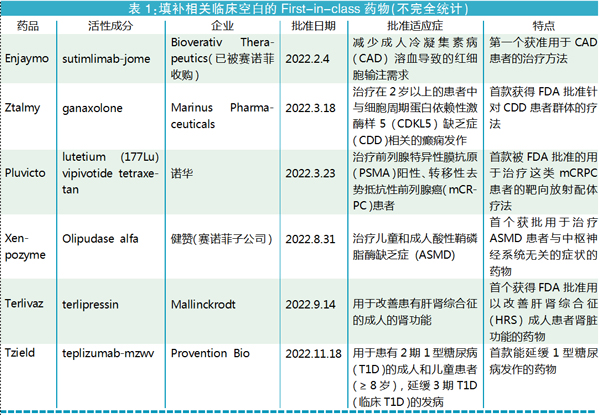
创新含量:FIC占比高,多项“首个”突破
虽然2022年获批的新药数量为近6年最少,但其创新“含金量”毫不逊色。据统计,2022年获批新药中属于“First-in-class”的有20个,占比达54.1% ,与2021年持平(见图4)。2015年至今,虽然每年CDER批准的“First-in-class”药物占比有波动,但总体呈向上走的趋势。
在这些“First-in-class”药物中,有些是相关靶点的首个成药,有些是首个上市的创新疗法,有些则填补了细分治疗领域的临床空白。同样值得关注的是,这些药物中有两个属于双抗药物。继抗体偶联药物(ADC)爆火后,全球双抗药物领域日益升温,商业化大潮在即。
例如,BMS的Sotyktu是全球首款TYK2抑制剂,也是近十年来全球首款获批上市的中度至重度斑块状银屑病口服治疗药物;勃林格殷格翰的Spevigo是全球首款IL-36R抗体,也是FDA批准的第1款全身性脓疱型银屑病(GPP)疗法;礼来的Mounjaro是FDA批准的首个GIP/GLP-1受体激动剂,也是近10年来获批上市的首个新型降糖药物;Immunogen的Elahere是全球首个FRα靶点ADC药物;Immunocore的Kimmtrak是首个获批上市的TCR-T疗法,这是首款用于治疗实体瘤的细胞疗法,也是FDA批准的首个用于治疗不可切除或转移性葡萄膜黑色素瘤(mUM)的疗法。
在细分治疗领域填补临床空白方面,还有首款能延缓1型糖尿病发作的药物Tzield;首个获得FDA批准用于改善肝肾综合征(HRS)成人患者肾脏功能的药物Terlivaz;首个获批用于治疗酸性鞘磷脂酶缺乏症(ASMD)患者与中枢神经系统无关的症状的药物Xenpozyme;首款被FDA批准的用于治疗前列腺特异性膜抗原(PSMA)阳性、转移性去势抵抗性前列腺癌(mCRPC)患者的靶向放射配体疗法Pluvicto;首款获得FDA批准针对细胞周期蛋白依赖性激酶样5(CDKL5)缺乏症(CDD)患者群体的Ztalmy;以及首个获FDA批准的用于冷凝集素病 (CAD)患者的Enjaymo等。
2022年FDA共批准了3个双抗药物,分别是罗氏的CD20/CD3双抗Lunsumio、VEGF-A/Ang-2双抗Vabysmo与强生的BCMA/CD3双抗Tecvayli。除了Vabysmo,其余均为First-in-class新药。加上2022年6月在国内获批的首个国产双抗卡度尼利(PD-1/CTLA-4,康方生物),2022年获批的双抗数量已赶上过去十几年的累积量,这意味着全球双抗研发管线正在进入收获期。
市场前景:19个潜在重磅药物
获批上市只是药企完成“万里长征”第一步,在商业化阶段研发线中的药品将面临更严峻考验。2022年FDA批准的新药市场前景如何?
根据FiercePharma梳理的预测数据,19个药品(11个属于First-in-class药物)有望成为“重磅炸弹”,其销售峰值将达到或超过10亿美元。
从药企来看,BMS可谓“大丰收”,获批新药不仅在数量上领先,市场前景也备受看好。其3个新药Camzyos、Sotyktu、Opdualag不仅在名单之列,且销售峰值预测排名也相当居前,均在40亿美元上下。此外,罗氏也收获颇丰,其获批的2个新药Vabysmo、Lunsumio均携手进入该名单,销售峰值预测分别达36亿美元与20亿美元。
尽管BMS与罗氏在数量上领衔,但礼来仅凭糖尿病新药Mounjaro(tirzepatide)就“一骑绝尘”。瑞银分析师对该药的销售峰值预测高达250亿美元,这将打破盘踞“药王”宝座数年之久的Humira(修美乐)的销售纪录,也是唯一一个销售峰值预测达百亿级的新药。
Mounjaro之所以备受青睐,不仅在于其是降糖领域的重磅新药,这一双靶点GIP/GLP-1受体激动剂还有望在日益火爆的减肥领域“大展拳脚”。
根据礼来2022年4月公布的Ⅲ期临床数据,在与司美格鲁肽的头对头试验中,tirzepatide表现相当出色。72周时间里,5mg、10mg、15mg等不同剂量组的受试者平均体重分别减轻16%、21.4%、22.5%。该公司表示,tirzepatide是首个在Ⅲ期临床试验中平均减重效果超过20%的研究性药物。
2022年10月,礼来宣布FDA授予tirzepatide快速通道资格,用于治疗成人肥胖或超重以及体重相关的并发症,并表示会在2022年滚动提交tirzepatide针对成人肥胖或超重的上市申请。这一适应症有望在2023年获批。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






