儿科临床试验何以告别步步惊心
发布时间:2023-01-05 16:05:18作者:王金湖(国家儿童健康与疾病临床医学研究中心)来源:医药经济报
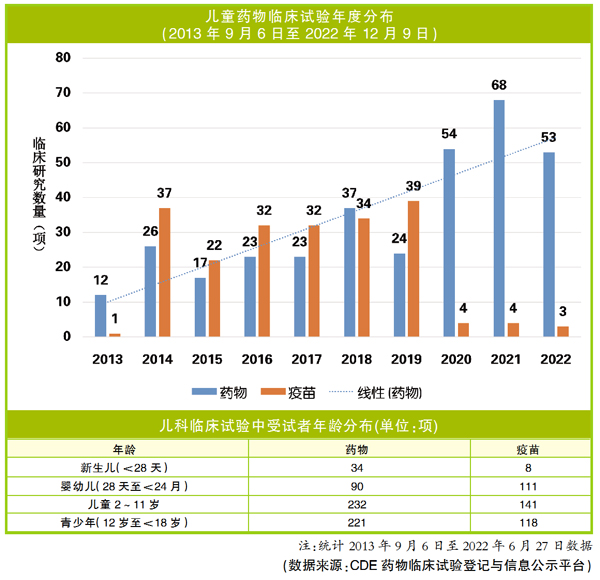
截至2022年6月,美国临床试验注册中心ClinicalTrials.gov登记临床试验项目420104项,其中儿童临床试验项目8461项,占比2.01%。在我国,根据CDE药物临床试验登记与信息公示平台数据,截至2022年12月9日,平台登记的试验总数为18602项,其中,儿童药物临床试验879项(药物337项,疫苗198项),在同期临床试验项目占比4.7%。相比之下,我们在儿科用药临床试验的数量上虽然有差距,但从2019年至2022年,我国儿童药物临床研究快速增长,特别是药物项目增长明显,2021年药物试验达到历史最高(68项),儿童药物研发表现出良好的增长态势,社会多方力量的努力初见成效。下一步,如何整合资源,建设一个更完善的儿科用药研发生态?需要思考几个问题。
关注需求缺口
儿科用药的需求缺口是巨大的。儿童疾病谱主要包括创伤、感染、肿瘤以及出生缺陷(结构畸形、遗传代谢病)。其中,结构畸形和创伤主要依靠手术治疗,感染性疾病药物与成人通用性较高,但儿童肿瘤和遗传代谢病境况完全不同。
以儿童肿瘤为例,作为儿童的头号杀手,儿童癌症已高居人类疾病负担第6位,世界范围内每年新增30万~40万名0~19岁肿瘤患儿,平均每1.5分钟确诊1个,20%的患儿在5年内死亡。
在过去20年,随着一批免疫、小分子靶向药物的应用,癌症治疗发生了天翻地覆的变化,FDA批准了190多种用于成人肿瘤的药物,专门用于儿童肿瘤的只有3个。由于儿童肿瘤与成人肿瘤存在疾病谱、发生机制以及驱动机制等方面的极大不同,针对成人癌症开发的药物多数不适用于儿童癌症,即便一部分可能让儿童癌症患儿获益的药物,其使用说明书中也没有儿童适应症,儿童癌症治疗没能搭上成人癌症精准治疗的“顺风车”,治疗基本依靠传统的铂类、蒽环类等细胞毒性药物。这导致原本总体疗效很不错的儿童肿瘤治疗成功率很难进一步提升,另根据澳大利亚Zero Childhood Cancer数据,依靠传统治疗手段,幸存患儿中有70%将面临远期毒副作用。
医院角色转换
“健康中国2030”规划纲要提出将“5岁以下儿童死亡率从2020年9.5‰降至2030年6.0‰”,如何降低癌症等重大疾病的死亡率是关键;中国儿童发展纲要(2021-2030年)明确要求开发治疗儿童恶性肿瘤等疾病的特效药。如何加强儿科用药的“新药研发+老药新用”?医院的角色转换很重要。
1.能提出临床需求
药物研发是以临床问题为导向的,儿科临床的需求是什么,我们就需要去研发什么。儿科医生最了解临床需求,但提出的临床需求不能是宽泛的、笼统的,要具体到什么人群、人群规模、什么需求、需求紧迫程度,并且提供相应的数据支撑,而这些数据都存在于医院。我国的儿科医生临床负担重,常无暇收集和整理,就有了“病例多、数据少”的困境,这导致临床需求的模糊和药物研发原动力的缺乏。能讲清楚临床需求,这是医院角色转换的第一层要求,近几年,随着越来越多医院建立专病数据库和病例登记系统,这种矛盾得到了一定程度的解决。
2.会凝练科学问题
所谓“凝练科学问题”指的是将临床需求的解决方案具体化。在传统的药物研发模式中,药物研发企业需要从这个环节切入,而对于儿科用药来说,这一点对药企要求太高,大大降低了研发效率。在很多比较成熟的研发模式中,这一步是由临床医生完成的,对医生和医院提出了更高要求。我们需要培养更多高水平的临床科学家,为儿童临床用药需求提出科学问题。
3.开展临床基础研究
临床是科学问题的来源,技术创新的需求所在,同时也是验证创新技术的舞台。目前我国药品研发以药企主导为主,国外很多儿科创新药物起源于医院的实验室。实际上医院有最直接的临床资源,如果能够把临床基础研究的体系建立和发展起来,将为新药研发提供最直接的动力。所以医院的角色转换核心是从“医院”转变为“研究型医院”,除了看病还要承担更多的研究工作。譬如科技部、国家卫健委等四部委联合建设国家儿童健康与疾病临床医学研究中心,目的就是整合中国儿科临床与基础的优势资源,实现临床与基础紧密结合,实现从临床到临床的闭环,引领和示范儿科新药和新技术研发。
建设试验平台
儿童人群的临床试验面临一系列困难,如:多是罕见病,病例稀缺,入组困难;伦理风险大,审查要求高;知情同意复杂,受试者保护要求高;服药困难、采血困难、客观和主观的依从性都不高等,这些让很多药企在开发儿童适应症的临床试验时望而生畏。怎样减少药企对儿科临床试验的顾虑?
我们需要建设一些大规模、高水平的儿科药物临床试验平台,为药企提供高质量的安心服务。这些平台需要能够利用好我国的人口资源优势,真正让“罕见病不罕见”,保障高效入组;能够提供严谨但友好的伦理审查环境;有一批经验丰富的研究者,能够有效应对知情同意、用药依从性、采血等困难。实际上在国内,浙江大学医学院附属儿童医院、首都医科大学附属北京儿童医院等一些大型儿童医疗中心在儿科药物临床试验方面已经有相当的规模和经验。
鼓足申办动力
儿科药物研发一个不可忽视的问题是如何保障药企的利益。罕见病受众小,上市后盈利困难,加上研发难度大,很多药企对儿科用药无论是“新药研发”还是“增加适应症”都望而生畏。很多药企凭着社会责任感来做儿科药物研发,社会责任虽然起重要作用,但一个领域的药物开发不能单纯依靠药企的社会责任感来承担。
1.协同降低成本 探索成人数据外推、采纳真实世界证据和真实世界研究支持等是降低药企研发成本的重要措施,充分利用已有数据,可以减少不必要的入组和资源浪费,近年国家出台了一系列的政策鼓励这类方法实施。此外,前文讨论的高效平台服务也能与药企相互成就,降低成本。
2.进行优先审评 目前国家已出台一系列政策,CDE成立药审中心儿童用药技术审评临床专家咨询委员会,也开辟了儿童用药快速审查通道,对于有市场急需、海外应用经验良好的药物给予优先审评、免临床注册等。这些措施可以让患者儿尽快用上药物,也降低了相关药企的开发成本。
3.保障投资回报 《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》提出“国家鼓励儿童用药品的研制和创新,支持药品上市许可持有人开发符合儿童生理特征的儿童用药品新品种、新剂型、新规格……对首个批准上市的儿童专用新品种、剂型和规格,以及增加儿童适应症或者用法用量的,给予最长不超过12个月的市场独占期,期间内不再批准相同品种上市。” 一定程度上保障了药企的利益。在罕见病方面,征求意见稿提出,罕见病新药在不断供情况下拥有不超7年的市场独占权,同样对儿童罕见病新药研发、开展新药的临床实践起鼓励作用。(本报整理)
结语
整体而言,在国家相关部门关于儿童用药研发系列利好政策的引导下,临床机构、研究机构与药企应联动起来整合资源,多方合力共建儿童用药研发新生态,共同提高儿科药物的开发效率。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






