研发国家队满格进击“世界杯”
发布时间:2023-01-01 01:19:42作者:本报研究策划中心来源:医药经济报
自实施药品审评审批制度改革以及全面开展仿制药一致性评价等创新政策以来,我国药品研发市场得到快速发展,药品研发的投入力度持续加大,新型治疗手段层出不穷,热门研发领域竞争越来越激烈,不断为全球药品市场注入活水。经过近几年的发展,我国药品创新呈现出新特征。
政策与资本成助推器
2017年以来,我国密集颁布多项与药品创新相关的政策和法规,为新药研发营造更好的市场环境。除了利好政策的不断加持,药品研发市场的规模增长也离不开医药行业持之以恒的投入。诚如医药界的“双十定律”:一款新药从研发到上市平均需要10年时间和10亿美元的投入。
从药品研发市场规模来看,2014年我国药物研发规模仅17亿美元,至2020年已达到103亿美元,GAGR(年均复合增长率)为35.0%,远高于全球药物研发规模的GAGR值(10.2%)。我国工商登记在册的医药研发企业数量从2017年仿制药一致性评价政策启动时的1000家左右,上升到当前的4300家左右,GAGR达到44.0%。
同时,资本推动也带动我国药品研发市场迅速发展。2021年,全球有超800家开发新技术和新疗法的公司公布融资和IPO消息,累计融资金额超过650亿美元。共有约120家开发新技术/新疗法的公司正式IPO,累计募资超过200亿美元。其中,百济神州创下2021年生物医药领域IPO最高纪录,募资近34亿美元。
中美研发线同中有异
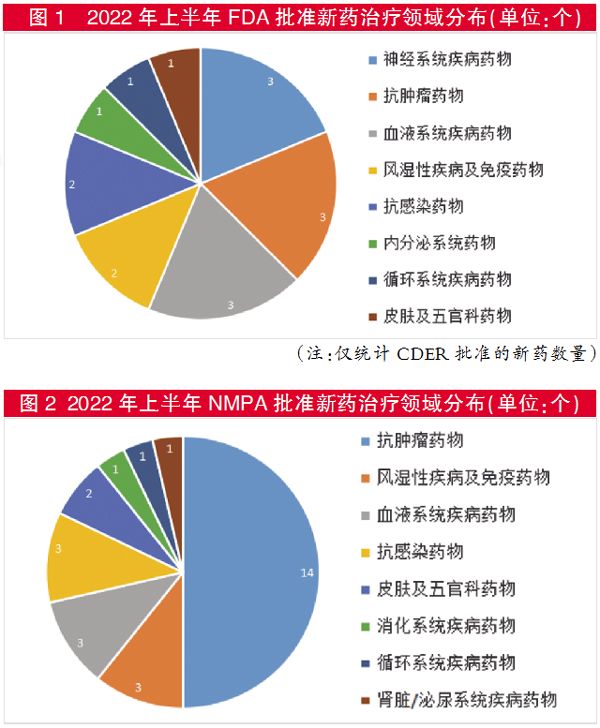
以2022年年上半年的上市批准数据为例。
上半年,FDA药物评估和研究中心(CDER)批准了16个新药,批准新药较均衡地分布在8个治疗领域,以抗肿瘤药、神经系统疾病药物与血液系统疾病药物领衔,各领域均有3个新药获批。
与之相比,国家药监局批准了28个新药,包括17个化药、10个生物制品(包括1个疫苗)和1个中药。其中,抗肿瘤药物占据“半壁江山”,达到14个。
从获批上市的治疗领域分布来看,国内与美国同中有异。无论美国还是中国,肿瘤领域都是研发和获批上市新药的热点;但从占比看,中国远远高于美国。美国获批新药中,占比与抗肿瘤并列的还有神经系统和血液系统药物领域(各占19%);而在中国,血液系统药物占比仅10.7%,神经系统用药则无,消化系统和风湿免疫获批上市药物占比较美国高。
我国在传统大分子化合物研发领域的基础与国外差距较大,主要原因是传统大分子化合物的创新研发已经呈现出“投入大、产出少”的局面,加之我国传统大分子化合物基础研发和药物专利的积累相比跨国制药企业处于弱势,因此我国要在传统大分子化合物创新研发方面取得重大突破,仍然存在不小的压力。
入国际赛道“弯道超车”
2021年国家药监局批准的83款新药中有10款曾被CDE纳入突破性疗法,有10款属于First-in-class新药,这是国产新药迈向原始创新的关键进展。
此外,中国创新药获得FDA批准的数量有所突破,例如百济神州的泽布替尼、石药集团的马来酸左旋氨氯地平、台湾中裕制药的艾巴利珠单抗等3款新药已经获得FDA的上市批准。仅2021年,就有君实生物、信达生物、百奥泰等多家企业向FDA递交了共5个新药上市申请。
2022年3月,传奇生物的西达基奥仑赛(cilta-cel)在FDA获批用于治疗复发或难治性多发性骨髓瘤。这是首款获得FDA批准的国产CAR-T细胞疗法,也是全球第二款获批上市的BCMA靶向CAR-T疗法。2022年5月23日,我国天济医药研发的Vtama(tapinarof)在美获批用于斑块状银屑病成人患者的局部治疗。
随着我国新药创制能力不断提升,国际竞争力不断增强,在未来一段时期,国内企业有望在新治疗领域如肿瘤靶点治疗、细胞基因治疗、疫苗等赛道实现“弯道超车”。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






