DMD新药国内上市对标先行区
发布时间:2022-12-26 11:02:44作者:伊遥来源:医药经济报
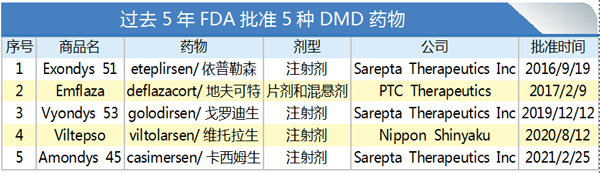
在过去5年里,FDA共批准5种杜氏肌营养不良症(DMD)药物,其在国内上市情况如何?
Amondys 45/Exondys 51/Vyondys 53
2016年9月,FDA批准了首款DMD药物,Sarepta Therapeutics公司的Exondys 51(Eteplirsen),用于治疗大约13%已明确51号外显子突变的DMD患者。Sarepta Therapeutics公司的Vyondys 53(golodirsen)和Amondys 45(casimersen)分别于2019年12月和2021年2月获得FDA批准,用于治疗外显子53跳跃(约8%)和外显子45跳跃(约8%)DMD患者。
Amondys 45/Exondys 51/Vyondys 53均为反义寡核苷酸药物,利用Sarepta专有的磷酸二酰胺吗啉代寡聚体(PMO)化学和外显子跳过(exon-skipping)技术,分别跳过DMD基因的第45号/51号/53号外显子。3款药物被设计用于结合肌营养不良蛋白pre mRNA的第45号/51号/53号外显子,从而在携带基因突变适合跳过第45号/53号/51号外显子的DMD患者的mRNA处理过程中排除或“跳过”该外显子。外显子跳过是为了允许产生一个内部截短的肌营养不良蛋白。
2021年9月,在博鳌乐城国际医疗旅游先行区特许医疗政策的支持下,博鳌乐城维健罕见病临床医学中心成功引入Amondys 45、Exondys 51、Vyondys 53。对于符合要求的DMD患者,这3种药物在乐城实现患者可及,为患者和家庭提供了多一个选择,也为患者获得良好的治疗提供了正规的路径。
Viltepso(viltolarsen)
2020年8月,FDA批准第二种针对外显子53跳跃DMD基因突变药物上市,是由日本新药株式会社(Nippon Shinyaku)子公司NS Pharma开发的Viltepso(viltolarsen)。
今年1月20日,湖南省儿童医院首个国际多中心53跳跃药Viltolarsen的Ⅱ期临床试验启动。Viltolarsen未来有望通过国家药监局途径申报上市。
Emflaza(deflazacort)
2017年2月,FDA批准PTC Therapeutics公司药物Emflaza(deflazacort),用于5岁及以上DMD患者的治疗。Emflaza是全球获批治疗DMD的首个皮质类固醇药物。与其他4种反义寡核苷酸药物相比,Emflaza的适用人群更为广泛,适用于所有类型基因突变的DMD患者。
据悉,Emflaza由西班牙Faes.Farma研发,于2003年被马拉松公司买入美国,随后又出售给PTC公司。而后在2017年,PTC公司使用了Faes.Farma的药学资料获得了美国FDA批准上市。2018年,澳门五洲药物与西班牙Faes.Farma签订许可协议,将与Emflaza同药不同名的Defal引入中国,并在2019年获得澳门批准上市,随后借助《粤港澳大湾区药品医疗器械监管创新发展工作方案》的政策开始以低价向内地进行销售。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






