脊髓性肌萎缩药研“冰雪消融”
发布时间:2022-12-22 10:40:40作者:大可 综合编译来源:医药经济报
在药物开发中,创新以两种方式发生,一是稳定增量,即新产品的每次迭代都比已有的产品略有改进;二是指数增长,即新药的疗效或安全性比现有疗法高出几个数量级。这两种方法都具有价值。因此去完善一款现有药物或寻找相同原则下的新方法,与开发新疗法一样具有创新性。不过这两种方法都应以满足市场空白下患者的短期和长期医疗保健需求为导向。
脊髓性肌萎缩症(SMA)是一种预后不良的复杂疾病,虽然某些分型的SMA患者在适当的护理下可以拥有正常寿命,但多数分型的SMA患者存活期通常不超过两年,目前尚无治愈方法。近日,Pharmaceutical Executive发表2023年度研发管道报告,在不断扩展和多样化的治疗领域中,SMA取得了渐进式的收益和巨大的飞跃。新兴药物实现了上述两种创新方式的结合,或建立在已有疗法的基础上,或发现了具有独特优势的创新方法。
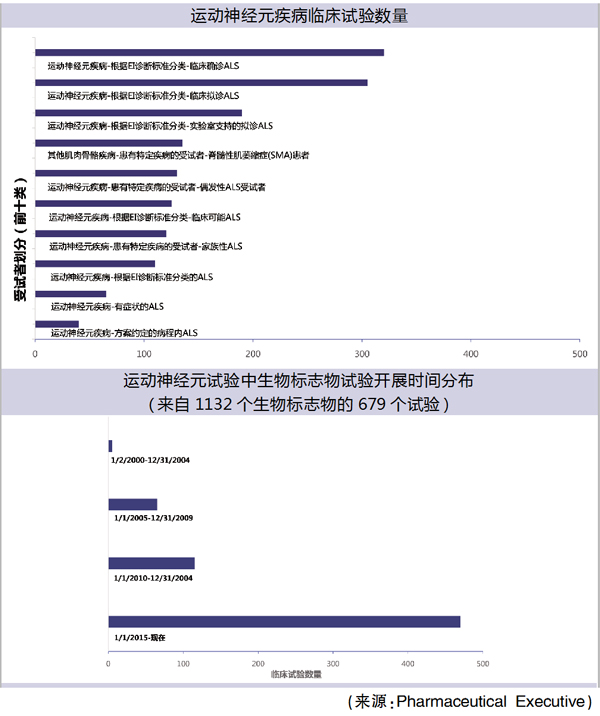
Clarivate Analytics的数据显示,目前有138项针对SMA的临床试验正在进行中。另外还有1408项针对其他运动神经元疾病,如ALS(肌萎缩性侧索硬化症)的药物研究,其中超过200项试验处于Ⅱ期临床阶段,近七年之内启动试验474项。
昂贵的Zolgensma备受挑战
SMA是基因靶向治疗的典型病例,尽早进行基因编辑就能产生影响,改变疾病进程。因而说到SMA治疗方法时,Zolgensma总会被首先提及。Zolgensma(索伐瑞韦,onasemnogene abeparvovic xioi)是诺华生产的一种基因疗法,以一次性静脉注射载体基因组的方式给药,经过30天的系统性糖皮质激素治疗后,通过腺相关病毒载体传递相关DNA到靶运动神经元细胞中,为早期接受治疗的患者带来巨大的获益。FDA于2019年批准Zolgensma用于治疗2岁以下SMN1突变的SMA患者。
2021年5月,诺华公司公布了START试验第一阶段结果。这项长期随访研究监测了13名接受Zolgensma治疗的SMA1型患者。如前所述,SMA1型是致命分型,患儿通常寿命不超过2岁。在试验中,10名接受了治疗的患者在5年后仍然存活:能独立呼吸,并且保持着运动神经元改善。
尽管Zolgensma在试验中显示出完美结果并获得FDA的批准,但其价格令人望而却步。2021年12月,《市场准入与健康政策》(Journal of Market Access&Health Policy)杂志授予Zolgensma“世界上最昂贵的药物”称号,单剂量输注成本为210万美元。虽然随着蓝鸟生物两款基因疗法Zynteglo、Skysona和CSL Behring首个B型血友病基因治疗药物Hemgenix的上市,该药已被挤出最昂贵药物前三行列,但洛杉矶DeciBio的生命科学专家William Orent博士表示,基因疗法的昂贵使其投资回报率备受挑战,特别是在医疗系统为单一支付的国家。然而,Orent认为,Zolgensma有明显的疗效优势,大多数国家的支付最终都会涵盖它。只是如果Zolgensma不降价,那么其他类型SMA药物的研发仍将继续,患者也期待看到更多的基因疗法。
新基因疗法鞘内注射OAV101
这是诺华另一款正在开发的SMA药物,也是一种基因疗法,在临床研究中有优秀表现。
鞘内注射OAV101的STEER试验曾被搁置,2021年8月,FDA在看到其毒理学研究的有利数据后解除了禁令。诺华目前正在进行STEER试验,这是一项Ⅲ期随机、双盲、安慰剂对照试验。值得注意的是,这项研究受试者比大多数SMA患者年龄大,该试验旨在改善2~18岁的SMA2型患者的运动功能。STEER试验涉及100多名受试者,并将使用Hammersmith功能性运动量表(HFMS)评估运动功能。STEER建立在STRONG试验基础上,STRONG是一项Ⅰ/Ⅱ期研究,它带来了患者HFMS评分的显著改善。
另一项名为STRENGTH的Ⅲb期临床试验将评估鞘内OAV101对2~12岁SMA患者的临床疗效、安全性和耐受性,这些患者曾接受过nusinersen(诺西那生纳)或risdiplam(利司普兰)治疗。该试验计划于2024年10月结束。
老药nusinersen迸发疗效新思路
nusinersen于2016年获得FDA批准,是首个上市的SMA药物,正在进行的研究对提高该药疗效有了新的见解。科学家在对之前的试验(CS3A和ENDEAR)数据进行二次分析时发现,脑脊液中nusinersen浓度越高,pNF-H浓度就越低,药物疗效就越高。nusinersen目前正在进行Ⅱ/Ⅲ期试验,即DEVOTE研究,以进一步检查剂量-反应关系,并评估高剂量情况下的安全性、有效性和药代动力学。这项研究有145名受试者,将评估nusinersen在最高50mg负荷剂量和不超过28mg/天的维持剂量下的不同效果。
taldefgrobep alfa辅助改善运动功能
与此同时,生物医药公司Biohaven目前正在进行taldefgrobep alfa(也称BMS-986089)的Ⅲ期临床试验,taldefgrobep alfa是一种研究性肌肉靶向重组蛋白,可作为肌肉生长抑制素。该试验被称为RESILIENT试验,旨在评估taldefgrobep作为一种辅助疗法,在已经使用稳定剂量nusinersen或risdiplam,抑或有Zolgensma治疗史的参试者中,相较于安慰剂组的有效性和安全性。这项研究将对年龄在4~21岁的SMA患者,进行每周皮下注射35mg或50mg的Taldefgrobep alfa。试验人员将在48周内,通过32项运动功能测量来评估受试者的运动功能。该试验于2022年7月开始,预计2025年1月结束。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






