新药商业化:流向有数,清醒择路
发布时间:2022-12-16 00:43:01作者:特约撰稿 边界来源:医药经济报
创新药真正进入了商业化落地的时代。在产品上市前的融资阶段,企业往往以“击鼓传花”的讲故事方式营造产品未来估值的“理想状态”;而一旦产品上市,就要面对市场的现实——当初上市前立下的产品预测,是否真能转化成目标销售额?
近期,业界纷纷探讨新药商业化。一方面,国内商业化成功的案例并不多,资本在产品上市前投入的资金难以退出;另一方面,企业为产品上市融资时定下的指标,在产品上市后必须要兑现。
本文对创新药上市后的医院渠道和药店渠道的市场情况进行分析,主要探讨目前国内创新药商业化的更优路径。
数据透视<<<
揭秘创新药终端覆盖意愿
药品商业化最终体现于产品在各终端渠道的市场数据。这个数据不仅体现出企业的市场营销能力,还体现出产品的商业化生产、供应链管理、市场准入等综合实力。
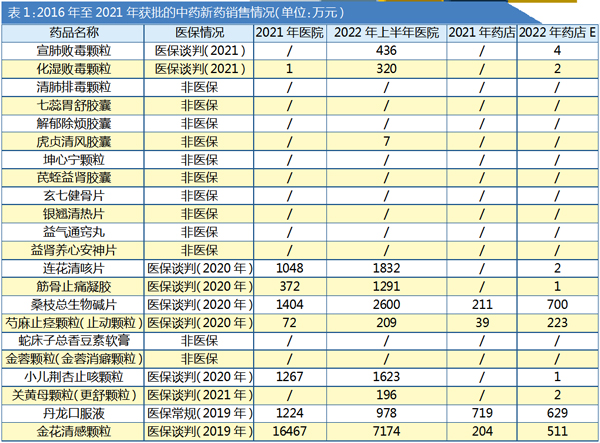
中药:首选医院渠道
2016-2021年获批的22个中药新药中,共有10个进入医保目录(含医保谈判目录),其中只有丹龙口服液进入医保常规目录。
如表1所示,没有进入医保目录的中药新药基本没有录得销售额数据。即使进入医保目录,仅金花清感颗粒的医院市场销售额能快速过亿元,桑枝总生物碱片2022年医院市场有望突破5000万元,连花清咳片和小儿荆杏止咳颗粒2022年医院市场有望突破3000万元。大部分产品难以突破千万元级别。从产品适应症来看,金花清感颗粒适用于外感时邪引起的发热、恶寒轻或不恶寒、咽红咽痛、鼻塞流涕、口渴、咳嗽或咳而有痰等,各类流感包括甲型H1N1流感所引起上述证候者。
从市场选择来看,中药新药普遍先选择在医院推广,其次才选药店。中药新药在药店的市场销售额普遍未过千万元。
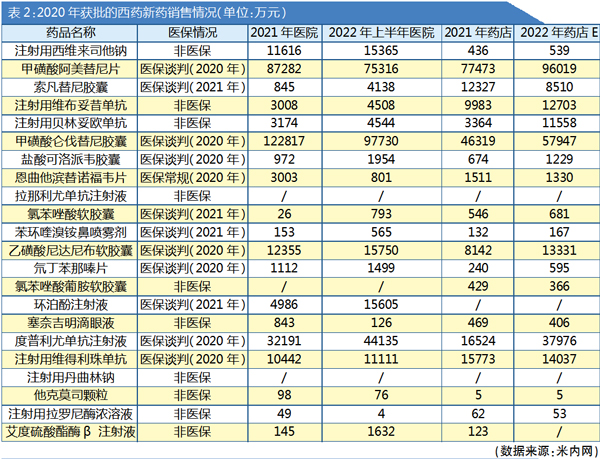
西药:更愿布局药店
2020年CDE年度审评报告提到22个获批的西药创新药(化学药+生物药,含新增适应症)中,仅恩曲他滨替诺福韦片1个产品在2020年医保常规目录,共11个产品进入医保谈判目录,其中7个为2020年当年就进入医保谈判目录。
相较于中药创新药寄望医院带动药店的销售模式,西药创新药更愿意在药店投入。不少西药创新药产品2022年药店市场表现优于医院市场(详见表2)。
例如注射用维布妥昔单抗和注射用贝林妥欧单抗。这两个单抗都属于抗肿瘤药物,也都是非医保产品,目标客户人群能接受在药店购买非医保产品。
[启示]
院外渠道愈发重要
中药新药企业还是停留在过往医院渠道带动药店渠道的路径依赖模式。在医院新开发药品难度大的当下,中成药的开发难度较西药更大。许多中成药企业还未充分利用医保“双通道”政策去覆盖药店终端、推动患者的可及化,未能同步医院推广到药店的更多患者。
中药新药商业化不理想,一直是限制中成药企业再投入创新药的一个重要因素。老药长期占据市场份额的大头,亦导致创新药的研发动力不足。习惯依赖于老药的中成药企业,尤其需要关注“同名同方”政策。一旦中药创新药和西药创新药一样具备“参比制剂”的资质,国内企业可以放开手去研发,那么必然会倒逼国内的中药企业去思考怎样的创新药才值得立题,并且如何开发中药创新药去满足临床未被满足的需求。
由于医院药品的名单有数量限制,西药创新药的医院终端开发同样有一定的难度,除非有显著的临床疗效能满足临床急需才有望开发进院。因此,西药创新药企业积极开发药店渠道。
对于中药创新药企业而言,除了考虑立项方向,还应该去学习西药创新药的商业化路径。
企业论策<<<
磨砺过亿新品几把“利器”
从过亿销售额的创新药爆品来看,肿瘤药和临床急需特效药在短期市场上依然是成功的选择方向。新增适应症可进一步扩大市场,也是大多数国内创新药上市后商业化会做的事。
非医保过亿:借力DTP药房
注射用维布妥昔单抗和注射用贝林妥欧单抗为非医保的过亿创新药产品,销售额主要来源于药店终端。
注射用维布妥昔单抗为全球首个CD30靶点抗体偶联药物(ADC),也是国内首个用于恶性淋巴瘤患者的ADC药物,适用于治疗复发或难治性的系统性间变性大细胞淋巴瘤和经典型霍奇金淋巴瘤。
注射用贝林妥欧单抗为全球首个双特异性抗体(CD3和CD19靶点)药物,适用于治疗成人复发或难治性前体B细胞急性淋巴细胞白血病。对于化疗失败的复发或难治性急性淋巴细胞白血病患者,与标准化疗相比,注射用贝林妥欧单抗可显著延长患者生存期。
除了上述两个产品,药店销售额过亿药品还有甲磺酸阿美替尼片、甲磺酸仑伐替尼胶囊、度普利尤单抗注射液、注射用维得利珠单抗等,由此可见肿瘤DTP药房已经比较成熟。
新增适应症:原渠道是铺垫
乙磺酸尼达尼布软胶囊是小分子酪氨酸激酶抑制剂(TKI),具有抗纤维化作用,增加适应症用于治疗系统性硬化病相关间质性肺疾病(SSc-ILD)和具有进行性表型的慢性纤维化性间质性肺疾病(PF-ILD)。其为2020年医保谈判品种,2022年获批新适应症。
尼达尼布在医院和药店两个渠道销售额都过亿元,与其上市多年的铺垫有关,而并非上市两年就做成过亿大市场。
Me-too/Me-better药:“快”为致胜关键
虽然业界一直不看好Me-too/Me-better药的同质化竞争未来,但首家上市的Me-too/Me-better药依然能够收到很好的市场回报。
甲磺酸阿美替尼片有望在上市两年后突破10亿元销售额。阿美替尼为我国首个具有自主知识产权的第三代靶向表皮生长因子受体小分子酪氨酸激酶抑制剂(EGFR-TKI)创新药物,适用于治疗既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌。
非小细胞肺癌是国内公认的最热癌种,EGFR-TKI目前是最热的化学药小分子靶点。有预测称2023年竞争厂家会在8家,甲磺酸阿美替尼片首家获批并同年进入医保,上市两年就有望突破10亿元。“快”是创新药商业化致胜的关键因素。但是,随着竞争的加剧,阿美替尼能否继续保持现有市场销售额仍待观察。
对于Me-too/Me-better药而言,同质化竞争并不可怕,而如何在第一梯队的竞争者中脱颖而出首家获批上市则非常关键。除了立项趁早,产品的前期研究工作扎实、生产管控和临床研究的速度把控、注册法规文件体系的完善,亦是首家获批的关键因素。这些因素都是非直观的市场营销能力。
此外,营销体系也是关键因素。恒瑞PD-1并非第一个上市,但市场表现非常好,就是因为恒瑞的营销体系比当时的竞争对手更有优势。
临床急需特效药:进医保非必选
对于临床急需特效药而言,如果患者人数多、市场需求大,也会出现潜力大品种。
上市3年有望突破10亿元销售额的还有度普利尤单抗注射液。度普利尤单抗注射液为重组人免疫球蛋白-G4单克隆抗体,适用于治疗外用处方药控制不佳或不建议使用外用处方药的成人中重度特应性皮炎,属临床急需境外新药名单品种。
整体而言,进入医保目录的新药产品销售情况比非医保更优。但是,非医保的新药产品的市场销售额也有过亿元的,例如适用于改善伴有全身性炎症反应综合征的急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)、全球唯一用于ALI/ARDS的药物注射用西维来司他钠,2022年销售额有望突破3亿元。该产品的市场表现再次印证了临床必需用药的市场潜力。因此,企业立项时,就要把握新药待开发的适应症,看已有治疗方案是否已经基本满足当前的临床需求。
即便是临床急需特效药,也要兼顾患者人数,才有望获得更高的商业化价值。比如,2020年获批的临床急需、国内首个用于罕见病黏多糖贮积症Ⅰ型(MPSⅠ,α-L-艾杜糖苷酶缺乏症)的酶替代治疗药物注射用拉罗尼酶浓溶液,以及国内首个用于罕见病黏多糖贮积症Ⅱ型(MPSⅡ,亨特综合征)的酶替代治疗药物艾度硫酸酯酶β注射液。这两个罕见病用药都没能进入医保,且患者人数太少,市场目前有限。
总结<<<
创新药的商业化最近备受业界关注,主要是因为近几年国内创新药的上市数量增加,当新药注册上市的路径被打通之后,投资者会更关注所投资新药的市场回报,即商业化。国内新药商业化成功的领域,目前主要还是集中于肿瘤药和临床急需特效药。渠道覆盖方面,药店渠道对于创新药的商业化越来越重要。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






