恒瑞国际战略进展超预期
发布时间:2022-12-16 00:33:15作者:杨泽康来源:医药经济报
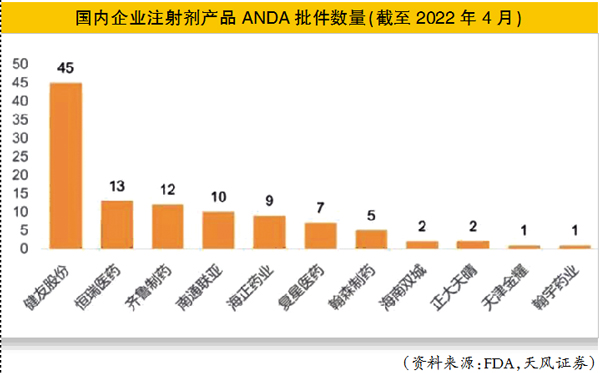
恒瑞医药在美国仿制药的申请和获批,今年出现加速迹象。
2020年以前,恒瑞医药获FDA批准的品种有14个,其中有10个注射剂。2020-2021年,恒瑞医药仅获得2个注射剂ANDA(美国仿制药申请)批文。
而今年,恒瑞医药造影剂仿制药ANDA出现井喷。4-5月公司的钆特酸葡胺注射液、碘克沙醇注射液ANDA先后获FDA批准;11月21日,钆布醇注射液ANDA获得批准。
2018-2021年,恒瑞医药海外收入均在6亿~8亿元人民币区间徘徊,占总收入的比重不超过5%。而更多的仿制药大单品海外获批,可帮助恒瑞医药对冲国内集采压力,助力公司重回季度业绩正增长。
海外仿制药品种增加,对于恒瑞未来国际化大有裨益。美国cGMP认证要求高,能通过的药企较为稀缺。而药企一旦打通ANDA申请路径,就有机会迅速复制到其他品种。恒瑞医药仿制药的探路,无疑为未来公司创新药“出海”夯实了基础。
公开信息中,恒瑞医药尚未明确海外销售模式。最新数据显示,恒瑞医药在欧美两地已经建立了涵盖医学科学、临床运营、注册、药理、统计、质量管理临床研发团队共计170余人。
今年5月成立的海外子公司Luzsana,虽然背靠恒瑞医药庞大的研发团队、选取超过11个高潜力项目,但就目前公司已经进入Ⅲ期的临床管线分析,海外创新药收入井喷仍需等待和积累。目前,其处于Ⅲ期临床的PD-1、PARP、JAK1、TROP等靶点管线,除了审批具有不确定性之外,在美国是否能打开市场仍然存疑。
不过,恒瑞医药的业绩拐点可能比想象中来得更快。预计2023年上半年恒瑞医药有望将仿制药的影响大部分出清。此外,新获批创新药进入医保谈判、仿制药出海顺利、团队精简与股权激励等多因素的补充,都将成为公司加速回到业绩增长正轨的动力,进而反哺创新投入。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






