拓维人参西行欧盟高质量路径
发布时间:2022-12-06 10:54:11作者:李得运 柳燕来源:医药经济报
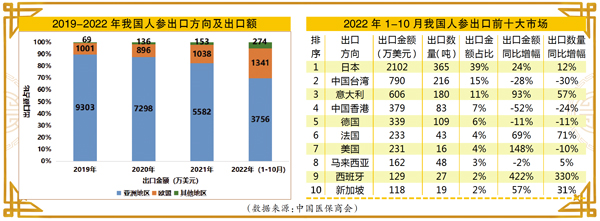
人参是我国中药材出口大品种之一,其中,亚洲地区一直是人参出口第一大方向,我国约90%的人参出口至亚洲地区。2019-2021年,亚洲地区的日本、中国香港和中国台湾稳居我国人参出口前三市场。不过自2019年以来,我国人参对亚洲地区出口额连年下降,相反,对欧盟地区的出口额则表现出快速增长势头。
欧盟人参市场升温
根据中国医药保健品进出口商会数据, 2022年1-10月,我国对欧盟出口人参365吨,同比增长29%,出口金额1341万美元,同比增长42%。欧盟市场在我国人参出口市场中的比重进一步升高,约占我国人参出口市场的25%。其中,人参出口前十大市场中,欧盟成员国占据四席,分别是意大利、德国、法国和西班牙,占人参出口总额的23%。其中意大利一跃晋升至人参出口第三大市场,排在日本和中国台湾之后、中国香港之前。
药用监管差异启发
1.欧盟人参可以按“传统植物药”注册
在人参产品按植物药进行注册时,根据欧盟《传统植物药注册指令》(2004/24/EC),如果一种植物药有30年以上药用历史,其中在欧盟使用历史不少于15年,且有充分文献数据证明其安全性和有效性,则可以按照“传统植物药”(Traditional Herbal Medicinal Product )简化注册程序进行注册,免除临床前和临床试验研究数据,相比欧盟主流的化学药或者其他植物药新药注册流程大大减少。已经有欧盟企业注册了人参单方的“传统植物药”产品 ,如SFI公司的Ginsana、Arkopharma公司的Arkopharma ginseng等。
人参制剂作为“传统植物药”销售,无需医生处方,消费者可以很方便地通过药店和其他途径购得,自行判断使用,类似于中国的非处方药(OTC),但是其适应症仅限于“疲劳和虚弱”(Fatigue and Weakness)。
虽然国内外关于人参对神经系统、心脏功能、免疫系统等的作用有诸多药理研究数据,欧盟也有关注到,但是欧盟植物药委员会(欧洲药品管理局下属专门机构)认为这些研究数据尚不能作为人参适应症的参考。究其深层次原因,是由于人参所含化学成分很多,其药效药理和安全性研究等远比欧盟主流的单成分化学药复杂。所以欧盟只是基于既成事实的传统使用习惯,对人参按药品注册做出有限度的妥协和让步。如果要注册有抗癌等其他功效的人参植物药,需要和新药注册一样,进行全流程的注册,难度更大。这也是我国的中药以“药品”身份走出去所面临的尴尬境遇。
人参制剂作为传统植物药,其适用人群仅限于成年人,不推荐孕妇、哺乳期女性和12岁以下人群使用。欧盟这一管理方式,与我国对人参作为新资源食品的管理较为接近。在我国药典中并未对人参入药禁忌人群做出规定。
2.欧盟植物药名录和植物药专论
欧盟植物药药品委员会(HMPC)依据相关法规,对可作为“传统植物药”注册的品种发布了“欧盟植物药专论”(European Union Herbal Monographs )和欧盟植物药名录(European Union list of herbal substance,preparations and combinations)。其中都收录了人参,对人参作为传统植物药的的植物原料规格、剂型、适应症、剂量、禁忌、用药人群、副作用等进行了规定,这是欧盟对人参作为传统植物药进行评审的依据,其中有些内容对我国人参出口企业、科研机构、监管部门有一定参考价值。
原料组成:欧盟植物药名录列出了6种人参药用原料的规格:①人参细粉(Conmminuted ginseng);②人参流浸膏: DER(Drug extraction Rate,干人参原料与制得的提取物的比重)1:1,用30%~40%乙醇提取;③人参干浸膏:DER:13~25:1,用28~40%乙醇提取;④人参干浸膏:DER:17~30:1,用70%乙醇提取;⑤人参干浸膏:DER:15~17:1,用水提取;⑥人参酊:人参与乙醇比例1:5。
以上规格对于我国人参制品出口企业有参考价值,可以对应开发这些规格的人参深加工产品,以满足欧盟客户的需要。
药物安全性:虽然人参可以作为传统植物药,患者在没有医生或药师指导的情况下自行用药,但是欧盟非常注重其副作用和长期使用的安全性。欧盟植物药名录和植物药专论中,列出人参可能的不良反应有失眠、易怒、心动过速、过敏反应(皮肤瘙痒)、恶心、呕吐、腹泻、便秘等。欧盟植物药名录规定人参用药期不得超过2个月。这些可以为我国开展人参安全性研究提供参考。
更进一步任重道远
我国是人参最大的出口国,欧盟市场上以人参为原料的传统植物药制剂,其原料甚至半成品绝大部分来自我国,但是无一例产品是我国中药企业注册的。究其原因,虽然欧盟对“传统植物药”注册程序简化了,但是欧盟对“传统植物药”的质量要求并未“简化”,比如要求人参种植过程符合欧盟GACP(Good Agricultural and Collection Practice ,药用植物种植和采集规范,类似于中国的GAP)要求、生产过程符合欧盟GMP要求、产品质量满足均一性、稳定性等要求。这些要求,对于中国人参出口企业或者中国药企来说,仍然是不小的挑战。但是只有迈过这道坎,中国人参贸易才可能实现从卖原料到卖产品的飞跃,真正实现“中药走出去”,因此,人参贸易的高质量发展,依然任重道远。
相关<<<
非药用人参欧盟困境
人参自17世纪初通过商业贸易进入欧洲,至今已有近300年使用历史。在欧盟,人参产品主要以食品补充剂(Food Supplement)、食品(Food)、植物药(Herbal Medicinal Product)和化妆品原料(Cosmetic Material)等形式在市场流通。
在欧盟所有成员国中,德国、法国、意大利是人参主要的消费市场。其中德国市场上,人参产品类型以植物药和食品原料(主要是人参茶)为主;在法国市场,人参产品类型以植物药和食品补充剂为主;在意大利市场,人参产品类型以食品、食品补充剂、化妆品原料为主。
欧盟对食品或食品补充剂销售实行备案制,上市难度较低。欧盟法规允许食品或者食品补充剂的包装或者广告上,做出营养声称(Nutrition Claim,比如“低支付”“富含膳食纤维”等)和健康声称(Health Claim,比如“儿童的骨骼生长和发育需要维生素D”),以突出产品的营养和健康价值、体现产品卖点,帮助消费者购买决策。这些营养声称和健康声称必须是准确真实、有科学证据基础的,不得有误导性信息或者宣传防病治病功效,这一点与我国对食品的管理相同。
欧盟出台的相关法规列出了食品或食品补充剂上准予标注的营养声称和健康声称,其主流的维生素类、微量元素类食品补充剂产品,基本都能从中找到合适的营养声称和健康声称。而人参作为植物类食品补充剂(Botanical supplement /Herb)产品销售,在法规中没有适用的营养声称和健康声称,宣传其健康价值时稍有不慎就会触犯欧盟法规,这是人参在欧盟作为食品或食品补充剂销售所面临的尴尬。值得我们共同思索。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






