FDA七个“首批”药显山露水
发布时间:2022-10-19 16:57:02作者:本报研究策划中心来源:医药经济报
上半年,FDA批准的新药数量为16个(仅统计药物评估和研究中心批准的新药,下同),显著少于去年同期(27个)。
进入第三季度,在经过7~8月的沉寂后(仅有1个新药获批),获批新药数终于在9月迎来强力反弹,达到9个。由此,第三季度FDA共批准10个新药上市,今年累计已有26个新药获批,与去年全年的50个新药相比,尚有一定距离。
第三季度获批的新药中,有不少是“首批”(首款获批)产品,如勃林格殷格翰的Spevigo、百时美施贵宝(BMS)的Sotyktu等。本文对“首批”药物进行分析。

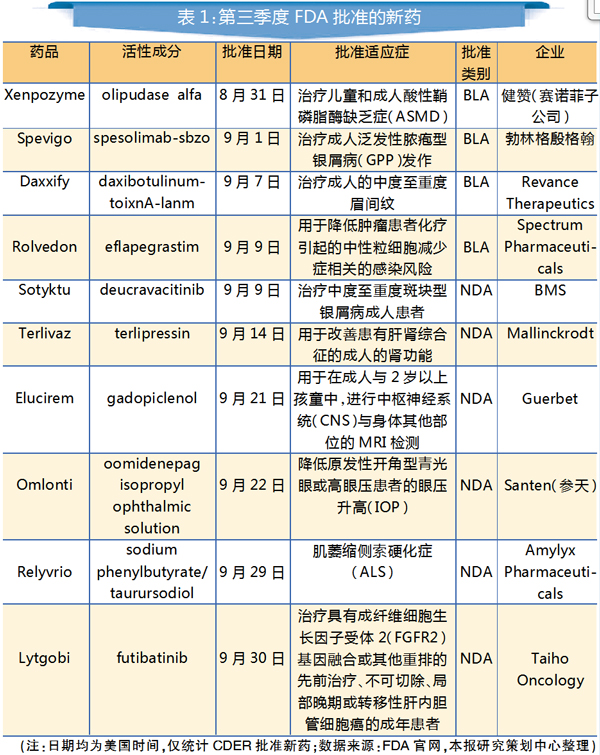
1. Xenpozyme(Olipudase alfa)
首款ASMD治疗药
Xenpozyme是FDA批准的第一个专门用于治疗酸性鞘磷脂酶缺乏症(ASMD)的药物,也是目前唯一获批的治疗该疾病的药物。在FDA批准前,该药已分别于今年3月和6月在日本和欧盟获批上市。
ASMD是一种极其罕见的进行性遗传疾病,其特征是缺乏酸性鞘磷脂酶(ASM)。ASMD患者由于编码ASM的基因出现突变,导致鞘磷脂在细胞中积累,造成肺、脾脏、肝脏等器官的损伤,可能导致早夭。Xenpozyme是一款人类酸性鞘磷脂酶重组蛋白,用于替代缺失或有缺陷的ASM。
2. Spevigo(spesolimab-sbzo)
首款IL-36R单抗
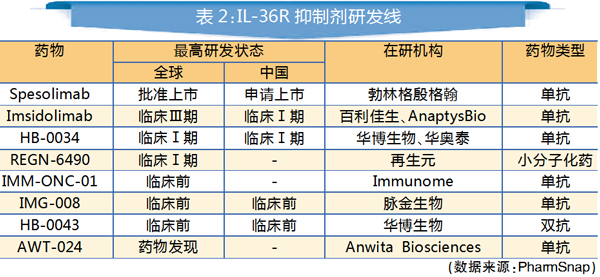
Spevigo是首个获FDA批准的成人泛发性脓疱型银屑病(GPP)疗法,也是全球首款IL-36R单抗,可阻断白细胞介素-36受体(IL-36R)的激活。与斑块状银屑病不同,GPP是一种罕见且可能危及生命的中性粒细胞性皮肤病,其特征是广泛爆发的疼痛性无菌性脓疱。IL-36R是免疫系统内信号通路的关键部分,被证明与GPP的病因有关。
在国内,Spevigo也已递交了上市申请,目前处于审评审批阶段。不少企业已布局IL-36R抑制剂研发,其中不乏国内药企的身影,如百利佳生、华博生物等,但目前国内临床研究均处于早期阶段。
3. Daxxify(daxibotulinumtoixnA-lanm)
首款长效肽制剂神经调节剂
Daxxify的活性成分为A型肉毒杆菌毒素,是首款获批的长效肽制剂神经调节剂。与目前常用的肉毒毒素注射产品相比,长效持久是其最大的特点,临床研究数据显示,其中位疗效持续时间达到6个月,部分受试者一次注射的疗效可维持9个月。
复星医药控股子公司已于2018年12月与Revance公司达成许可协议,获得Daxxify在中国内地、中国香港、中国澳门地区商业化的权利。药物临床试验登记与信息公示平台显示,目前复星医药正在开展2项Daxxify用于治疗孤立性颈部肌张力障碍和中重度眉间纹的Ⅲ期临床试验。
4. Sotyktu(deucravacitinib)
首款TYK2抑制剂
Sotyktu是近10年来全球首款获批上市的中度至重度斑块状银屑病口服治疗药物,也是全球首款酪氨酸激酶2(TYK2)抑制剂。TYK2是JAK家族成员之一,在介导促炎性细胞因子(包括IL-12、IL-23和Ⅰ型干扰素)的信号传导中起重要作用。
截至目前,全球约有近30款TYK2抑制剂在研,其中Priovant与辉瑞的brepocitinib已处于Ⅲ期临床阶段。国内布局TYK2抑制剂的企业包括百济神州、诺诚健华、启元生物等。
5. Rolvedon(eflapegrastim)
首款长效G-CSF药物
Rolvedon是20多年来首个获得FDA批准的新型长效粒细胞集落刺激因子(G-CSF)药物,通过柔性的PEG连接子将重组人G-CSF与IgG4 Fc片段共价相连,与Fc片段结合的独特结构赋予该药更长的半衰期与更高的活性。
长效G-CSF已接替短效G-CSF,成为G-CSF市场容量扩张的新动力。Insight数据库数据显示,目前已获批上市的国产长效G-CSF生产企业仅4家,分别是齐鲁制药、鲁南制药、石药百克与恒瑞医药。此外,双鹭药业、亿帆医药与特宝生物已提交了上市申请。值得一提的是,亿帆医药的贝格司亭(F-627)已向美国FDA递交了上市申请,但在今年3月收到FDA通知,因旅行限制,FDA将推迟F-627上市申请批复,直到现场检查完成。
6. Terlivaz(terlipressin)
首款HRS治疗药
Terlivaz是全球首个获FDA批准用于改善成人肝肾综合征(HRS)患者肾功能的疗法。HRS是一种晚期肝病常见的致命并发症,目前肝移植是唯一的治愈办法,但肝源稀缺使得肝移植可遇不可求,且患者往往来不及进行肝移植便会面临死亡。
事实上,Terlivaz是一款老药,已有30余年的获批历史,此前已在美国以外的40多个国家及地区获批用于治疗肝硬化并发症。如今,通过重新定位成为治疗HRS的首款药物,为那些危重患者带来了重要的治疗选择。
7. Relyvrio(sodium phenylbutyrate/taurursodiol)
首款延缓ALS疾病进展药
Relyvrio为苯丁酸钠和牛磺酸二醇两种药物组成的复方制剂,是FDA批准的第3款肌萎缩侧索硬化症(ALS,俗称“渐冻症”)治疗药物(其余两种药物分别是1996年、2017年获批的利鲁唑与依达拉奉)。ALS是一种进行性神经退行性疾病,影响大脑和脊髓中的神经细胞,目前发病机制尚不明确,也没有特效药。Relyvrio是首款在随机、安慰剂对照临床试验中显著延缓ALS疾病进展并能延长生存期的治疗药物。
下一个ALS新药也可能即将到来。今年7月,渤健和Ionis制药的在研反义寡核苷酸疗法tofersen的上市申请(用于治疗超氧化物歧化酶1突变所致的ALS)获FDA受理,并同时获优先审评资格,审评截止日为2023年1月25日。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






