靶向CSC分兵擒贼先擒王
发布时间:2022-10-13 09:31:14作者:秦卫华(中山大学药学院新药研发中心原常务副主任)来源:医药经济报
癌症干细胞(CSC)是一类多能细胞,已在大多数类型的实体癌和血液癌中观察到。CSC具有与正常干细胞类似的“干性(Stemness)”,具有自我更新和分化成多种类型细胞的特性,即便把癌组织的“枝叶”摘除,但其“树干”“种子”仍在,就会再发新枝。实体癌通过手术切除、化学疗法、免疫疗法和/或放射疗法进行治疗,然而,因 CSC的肿瘤异质性及与非CSC相比具有不同的基因型、表型和生物学行为,容易促进肿瘤生长和逃脱监测,造成肿瘤复发、转移,这也是其耐药的主要原因,并导致了很高的发病率和死亡率。
CSC的信号通路、肿瘤微环境(TME)在内的多种因素在调节CSC过程中发挥着至关重要的作用,近来靶向CSC研发出现热潮,其中一些在临床前,有的则已经进行临床试验,现对靶向CSC药物研究方向及其相关进展跟踪报道。
1. 唤醒静止的CSC
已知CSC在肿瘤内处于静止状态。它们不仅逃避了针对快速分裂癌细胞的药物追击,而且还产生了耐药性。因此,通过触发细胞分裂、诱导细胞凋亡或逆转其干性来特异性靶向CSC可能是对抗肿瘤生长和转移的合理方法。例如,CSC可以在氧化磷酸化和糖酵解之间切换以支持肿瘤生长。因此,抑制糖酵解等葡萄糖代谢会降低自我更新能力,而CSC的肿瘤起始潜力可用作抑制肿瘤生长的有效策略。
2. 靶向关键信号通路
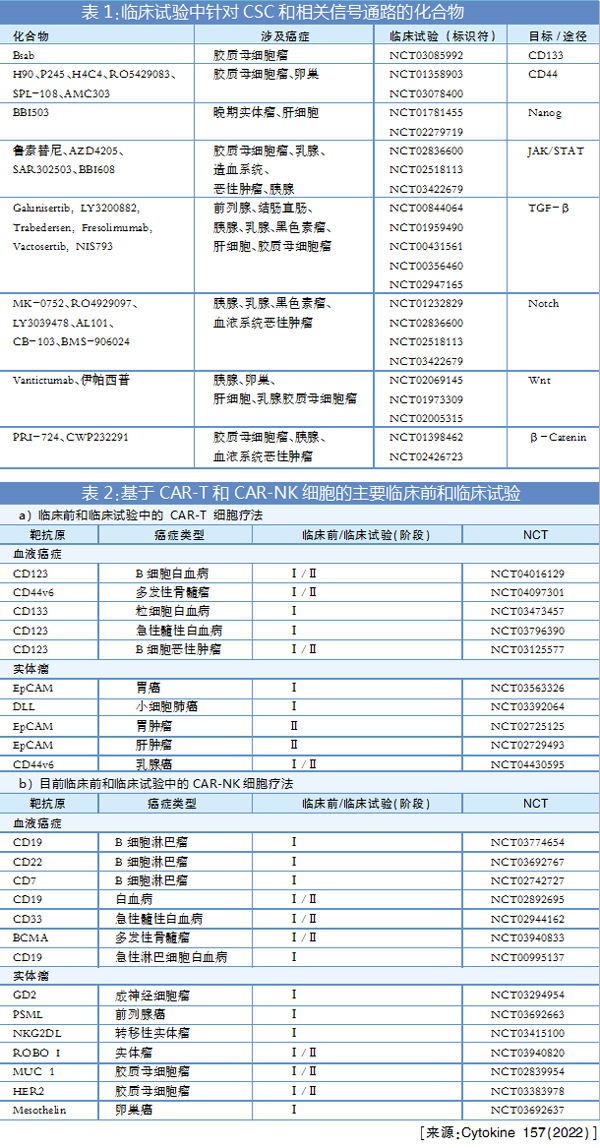
主要参与CSC维持和存活的信号通路已被证明是癌症治疗的潜在目标。在CSC中充当节点的主要信号通路带来了许多令人兴奋的临床前结果。表1是目前在临床试验不同阶段针对各种信号通路的化合物。
3. 靶向表观遗传调节剂
表观遗传变化,如DNA甲基化和组蛋白乙酰化/去乙酰化,是CSC表型获得的基础,也影响治疗耐药性和肿瘤复发。因此,靶向表观遗传调节剂可能是消除CSC的可行选择。DNA甲基化的作用已在癌症的各个阶段得到确认,包括CSC。同样,组蛋白的乙酰化和去乙酰化是包括癌症在内的许多疾病的关键表观遗传修饰。组蛋白乙酰转移酶将乙酰基与组蛋白和非组蛋白中的赖氨酸残基结合,组蛋白去乙酰化酶(HDAC)从中去除乙酰基。HDAC3和HDAC7在CSC中过度表达,导致癌干细胞标志物增加。FDA已经批准了几种用于治疗各种癌症的HDAC抑制剂,如恩替司他、辛二酰苯胺异羟肟酸和伏立诺他酸,这些抑制剂通过消除CSC群来抑制肿瘤生长。
4. 纳米药物
纳米技术在靶向CSC治疗中非常有前景。抗癌药递送到实体瘤存在多种生物学障碍,例如肾、肝或免疫清除,载有药物的纳米颗粒可克服这些生物障碍,提高疗效。
1995年,第一个抗癌纳米药物Doxil获得美国食品药品监督管理局(FDA)批准时,PubMed搜索“nanoparticles for cancer”关键词,只有23篇文献。而在2019年,使用相同关键词,已经搜索到超过25000篇文献,至2022年9月,在临床试验数据库(clinicaltrials.gov)中,共有144个条目涉及抗癌纳米药物。
虽然有大量文献将不同的纳米颗粒描述为潜在的癌症疗法,但只有少数获得了FDA的批准。纳米药物临床转化难的原因一是成本高,一种新型纳米药物商业化过程需10~15年,甚至更长时间,成本约为10亿美元;二是生产稳定性、质控都有待提高;三是纳米药物的药代和毒理学仍有很多未明之处,尤其是与免疫系统的相互作用等,这些因素限制了抗癌纳米新药的面市。
5. 表面生物标志物
单抗(mAbs)是靶向CSC表面抗原的有效治疗选择。最近有几种化合物和药物被用于靶向CSC。例如,利妥昔单抗靶向治疗淋巴瘤中的CD20,adecatumumab靶向腺癌、乳腺癌、前列腺癌和结直肠癌中的EpCAM表面标志物。
6. 免疫疗法
CAR-T细胞疗法涉及对患者来源的T细胞进行工程改造,再注射到患者体内以对抗肿瘤。CAR-T疗法已经发展了四代,现CAR-T靶向CSC药物也进入视野,其临床前和临床试验见表2a。
CAR-T疗法通常用于血液肿瘤的治疗,在实体瘤欠佳。细胞因子释放综合征和神经毒性等挑战是CAR-T疗法的主要副作用,其有限疗效和挑战促成了新的免疫疗法,例如CAR-NK疗法。
自然杀伤(NK)细胞是一类细胞毒性免疫细胞,NK细胞比T细胞更安全,没有细胞因子释放和移植物抗宿主病(GVHD)问题。凭借其毒副作用更低和疗效更佳的优势,肿瘤免疫治疗研发重点已从CAR-T疗法转移到CAR-NK疗法,基于CAR-NK的临床前和临床试验的现状见表2b。
★★★ 七重关卡待闯 ★★★
尽管目前靶向CSC取得一些进展,但要斩草除根、完全消除CSC,还需要解决多个障碍。
第一,特定类型肿瘤CSC的许多特征尚未得到很好的识别;第二,大多数CSC研究是在缺乏相应的免疫系统,在免疫缺陷小鼠中进行的,这些模型并未概括临床肿瘤的生物学复杂性;第三,CSC存在于维持其生存的特定TME,而目前大多数CSC研究缺乏TME,且CSC生态位因素尚未得到很好的了解,针对CSC的TME新药尚需探索;第四,由于CSC还与正常干细胞共享一些信号通路,并非所有促成CSC的调节因子都适合用作癌症治疗的靶点,一些针对CSC信号传导的抑制剂不够特异,需要设计新的抑制剂;第五,是否应该激活或阻止CSC是癌症治疗中的一个悬而未决的问题;第六,新的信号传导和更多的调控水平,如RNA编辑、表观遗传学和细胞代谢,应在靶向CSC治疗中加以考虑,因为它们也有助于CSC的干性;第七,还应研究针对CSC的天然产物,减少CSC靶向药物的毒副作用。
随着对治疗性疫苗、自噬、线粒体、外泌体、溶瘤病毒的深入研究,靶向CSC不断涌现新的成果。由于单一疗法通常不足以根除CSC,靶向CSC的多模式、组合式疗法将是最佳选择。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






