中成药立项切准价值脉动
发布时间:2022-08-04 15:37:07作者:特约撰稿 边界来源:医药经济报
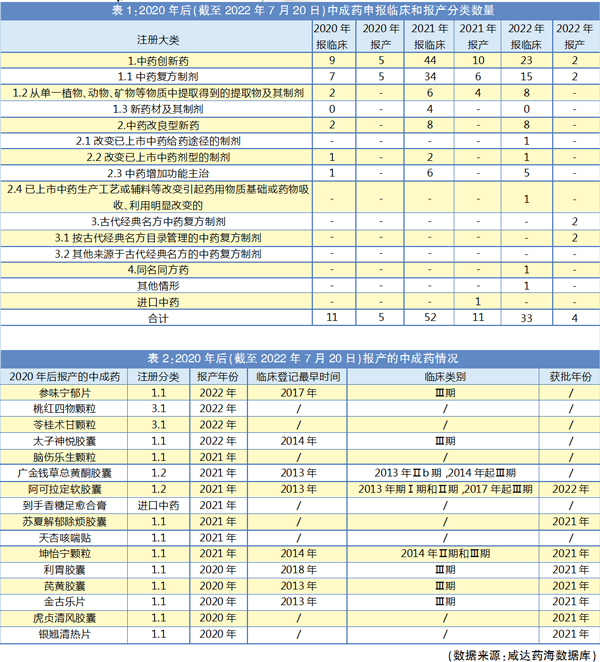
申报临床与报产分类追踪与分析
自2020年7月1日正式施行的新《药品注册管理办法》,将中药注册按照中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药等进行分类。2020年9月27日,国家药监局发布《中药注册分类及申报资料要求》,明确了中成药分类。
本文追踪2020年至今(截至2022年7月20日)中成药申报临床和报产的情况,并分类进行剖析,探寻中药研发的立项机会。
从申报注册数据可见,中药研发逐步回暖。但是,备受业界关注的古代经典名方中药复方制剂(3类中药)和同名同方药(4类中药)目前申报数量还有待提高。
中药创新药:Ⅲ期临床项目将引交易热
中药创新药,即1类中药,是指处方未在国家药品标准、药品注册标准及国家中医药主管部门发布的《古代经典名方目录》中收载,具有临床价值,且未在境外上市的中药新处方制剂。又细分为1.1类、1.2类和1.3类。
咸达药海数据分析发现,中药创新药无论报临床还是报产,都是申报分类中数量最多的。值得关注的是,中药创新药的报产在2021年数量下滑。
中药创新药在2020年报产的5个产品,申报名分别为利胃胶囊、芪黄胶囊、金古乐片、虎贞清风胶囊和银翘清热片,都已获批上市。2021年申报的10个受理号中,申报名坤怡宁颗粒、苏夏解郁除烦胶囊、阿可拉定和阿可拉定软胶囊都已获批上市。天杏咳喘贴3个受理号已发药品通知件,但暂时查不到批文上市信息。
其中,1.1类(中药复方制剂)又是报临床和报产申报数量最多的细分分类。1.3类(新药材及其制剂)只有在2021年有产品报临床,但暂无产品报产。
2020年以后,报产获批上市的中药创新药基本上都是口服固体制剂,暂无中药注射剂获批上市。国内中药市场规模占比较大的剂型中药注射剂仅2个产品申报临床,为江西青峰药业的注射用丹酚酸A以及广西馨海药业与江西中医药大学联合申报的注射用B4,都是1.2类(从单一植物、动物、矿物等物质中提取得到的提取物及其制剂)。
2020年以后报产的16个中药制剂中,共8个在药物临床试验登记与信息公示平台有登记数据,全部都是1类中药新药。其中2013年就启动Ⅲ期的有2个,2014年启动Ⅲ期的有3个,最终获批上市3个,都在2021年获批。据咸达药海数据库数据,坤怡宁颗粒和金古乐片在2005年申报临床,芪黄胶囊在2007年申报临床,这意味着这三个产品从申报临床到获批花了近15年,如果加上立项到临床前研究的时间,预计耗时更长。利胃胶囊虽然2018年进入Ⅲ期临床、2021年获批,但这个项目首次申报临床是在1998年,实际上耗费时间预计近25年。
【立项启示】 中药创新药(1类中药)是目前获批成功率最高的产品,但中药注射剂基本已不是各企业的立项关注重点。
中药创新药研发周期普遍在15年以上,如何利用现有法规加快审评审批速度,会是各企业关注的重点。例如:中药口服药如果是院内制剂,可以豁免部分临床研究,有望缩短整个项目研发时间。已经进入Ⅲ期临床阶段的中药创新药未来有望成为交易热点。
中药改良型新药:寻不同用药途径改良项目
中药改良型新药,即2类中药,是指改变已上市中药的给药途径、剂型,且具有临床应用优势和特点,或增加功能主治等的制剂;又细分为2.1类、2.2类、2.3类、2.4类。
2022年(截至2022年7月20日),中药改良型新药的申报临床数量已经与2021年持平,但暂无产品报产。其中,2.3类(中药增加功能主治)申报临床数量是报产申报数量最多的细分分类。
【立项启示】 根据目前的中成药集采规则,同一用药途径的剂型大概率要进行合并集采。因此,除非改良药为不同的用药途径,否则未来中药改良型新药都很可能受到别的产品的价格影响。预计同一用药途径的中药改良项目未来鲜有立项。
另外,由于中药注射剂获批几率小,因而中药改良药用药途径改良较好的方向是:中药注射剂改为口服药,或中药注射剂改为外用药,或中药口服药改为外用药。
经典名方复方制剂:7大方剂为短期申报热点
古代经典名方中药复方制剂即3类中药。古代经典名方是指符合《中华人民共和国中医药法》规定的,至今仍广泛应用、疗效确切、具有明显特色与优势的古代中医典籍所记载的方剂;古代经典名方中药复方制剂是指来源于古代经典名方的中药复方制剂。
古代经典名方中药复方制剂不需要启动临床就可以直接申报,2022年才开始有2个受理号报产,都是3.1类(按古代经典名方目录管理的中药复方制剂),分别为合肥华润神鹿药业的桃红四物颗粒以及江苏康缘药业的苓桂术甘颗粒。桃红四物汤和苓桂术甘汤都在2018年国家中医药管理局会同国家药品监督管理局制定的《古代经典名方目录(第一批)》里,并且2020年被收载进入《古代经典名方关键信息表(7首方剂)》。
【立项启示】 鉴于目前所公布的《古代经典名方关键信息表(7首方剂)》中只有7个产品,分别是:苓桂术甘汤、温经汤、一贯煎、桃红四物汤、升陷汤、枇杷清肺饮和二冬汤。预计古代经典名方的第一批申报热点也将围绕这7个产品,并且大概率2022年起陆续就有企业申报,且申报剂型以颗粒剂为主。但是,这类产品的研究门槛并不高,未来谁掌握核心药材,谁就有望打赢这类产品的价格战。
同名同方药:能否豁免生物等效性研究?
同名同方药,即4类中药,是指通用名称、处方、剂型、功能主治、用法及日用饮片量与已上市中药相同,且在安全性、有效性、质量可控性方面不低于该已上市中药的制剂。
2022年(截至2022年7月20日),同名同方药终于有1个产品申报临床,为民族药通阻合牙日仙拜尔片。
【立项启示】 同名同方目前申报的企业并不多,关键因素在于指导原则未出。中药仿制药究竟是否需要和化学药仿制药一样做生物等效性研究,目前尚未明确。
如果要做生物等效性研究,则同名同方的研发难度将加大。其中,中药注射剂更像化学药的多组分注射剂,大概率难以豁免生物等效性研究。预计可以豁免生物等效性研究的可能是组分比较单一的口服液体制剂。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






