FDA上半年新药审批慢节奏
发布时间:2022-07-25 14:42:40来源:医药经济报
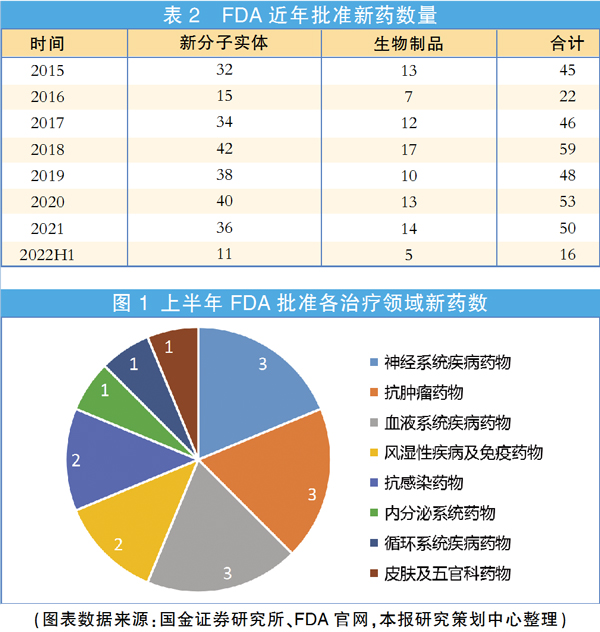
近几年,美国获批新药数量一直保持在高位,不过据FDA官网数据初步统计,今年上半年,FDA药物评估和研究中心(CDER)仅批准了16个新药,而去年同期多达27个。FDA似乎放缓了审批步伐。
从企业构成来看,来自大型跨国药企的新药占比未过半,仅BMS(2个)、辉瑞(1个)、礼来(1个)、赛诺菲(1个)、罗氏(1个)与诺华(1个)有所斩获。从治疗领域构成来看,与国内上半年新药中抗肿瘤药占比一半不同,FDA批准新药较为均衡地分布在8个治疗领域中,以各有3个新药获批的抗肿瘤、神经系统疾病与血液系统疾病领域领衔。
3个潜在“重磅”入场
今年年初,FiercePharma发布了2022年最值得期待上市的十大药品名单,列出了具有“重磅炸弹”级潜力的新药,Camzyos、Mounjaro与Amvuttra均在列,这三者也顺利在上半年获批。
Camzyos获批用于治疗梗阻性肥厚型心肌病(oHCM)成人患者,是FDA批准的首款心肌肌球蛋白别构可逆性抑制剂。该药是BMS在2020年以131亿美元收购MyoKardia的核心产品,或成为重磅产品阿哌沙班(Eliquis,2021年全球销售排名第5)在美国专利到期后该公司心血管领域的新支柱。据FiercePharma预测,2026年Camzyos的销售额将达17亿美元。
Mounjaro是葡萄糖依赖性促胰岛素多肽(GIP)受体和胰高血糖素样肽-1(GLP-1)受体双重激动剂,为近十年来首个新型降糖药。该药的优势在于,不仅能帮助2型糖尿病患者控制血糖,还能帮助肥胖患者减轻体重。为此,礼来将与诺和诺德展开正面交锋,后者的核心产品司美格鲁肽(Ozempic)已被美国FDA批准用于治疗肥胖症。据FiercePharma预测,2026年Mounjaro的销售额将达49亿美元。
Amvuttra是一款罕见病药,用于治疗成人遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性多发性神经病变,是Alnylam获批的第四款RNAi疗法。该公司此前已上市hATTR淀粉样变性药物Onpattro,但其需每3周注射1次,而Amvuttra为每3个月皮下给药1次,更为便捷。ATTR市场竞争正在逐渐升温。目前,辉瑞的氯苯唑酸葡胺(Vyndaqel/Vyndamax)表现出色,2021年销售额增长170%,达到12.88亿美元。去年,阿斯利康与诺和诺德都通过交易获得了ATTR在研项目。据FiercePharma预测,2026年Amvuttra的销售额将达到18亿美元。
中国药企“花开彼岸”
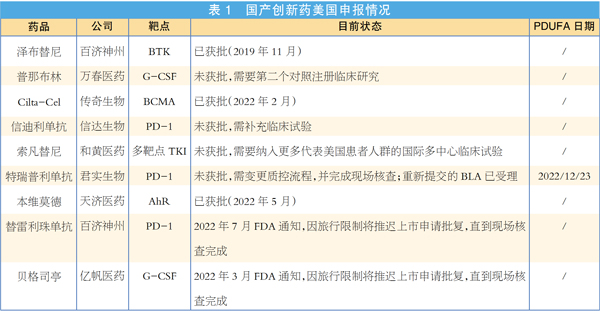
今年以来,FDA药物审批收紧,国产创新药出海难度升级。信达生物、和黄医药、君实生物相继收到FDA完整回复函,信迪利单抗(信达生物)与索凡替尼(和黄医药)均需补充国际多中心临床试验以支持其在美国获批,特瑞普利单抗(君实生物)则被要求进行一项质控流程变更。
尽管如此,上半年仍有本土新药成功闯关。5月23日,Vtama(tapinarof)在美获批用于斑块状银屑病成人患者的局部治疗。Tapinarof中文通用名本维莫德,由天济医药研发,2019年已在国内获批上市,Dermavant目前负责该药的境外开发。
此外,传奇生物的西达基奥仑赛(cilta-cel)在今年3月获批用于复发或难治性多发性骨髓瘤。这是首款获得FDA批准的国产CAR-T细胞疗法,也是全球第二款获批上市的BCMA靶向CAR-T疗法,目前强生负责该产品在国外的开发和商业化。需要指出的是,该药由FDA生物制品评估和研究中心(CBER)审批,故在上述统计中未被纳入。西达基奥仑赛也被FiercePharma列入今年的十大上市新药,据其预测,2026年该药销售额将达17亿美元。
国际化是本土创新药企长期生存的必经之路,而FDA等监管审批体系和要求的不断变化,对国内创新药出海提出了更高要求,需要本土企业及时作出应对与调整。
日前,君实生物宣布,FDA受理了重新提交的特瑞普利单抗的生物制品许可申请(BLA),其处方药用户付费法案(PDUFA)的目标审评日期为2022年12月23日。百济神州的替雷利珠单抗原本也将在下半年迎来FDA的审批决定(PDUFA日期为2022年7月12日),但该公司近日发布公告称,美国FDA因新冠肺炎疫情相关的旅行限制,无法如期在中国完成所需的现场核查工作,因此将延长替雷利珠单抗的目标审评完成时间。目前诺华负责替雷利珠单抗在北美、欧洲和日本的开发、生产和商业化。
下半年新药看点
过去两年,FDA批准的新药数量分别为53个与50个。从上半年获批新药数量来看,若要继续保持这一水平,下半年FDA必须开足马力。在尚待审批的大量新药中,也不乏一些备受关注的重磅产品。医药网站BioSpace指出,肌萎缩性脊髓侧索硬化症(ALS)、早期脑肾上腺脑白质营养不良(CALD)与庞贝氏症(Pompe Disease)等治疗领域有望迎来“规则改变者”。
例如,Amylyx的ALS新药AMX0035已于今年6月在加拿大获批上市,FDA的审评因为新增数据而有所延迟,专家委员会计划在9月初再开会对新增数据进行讨论。Bluebird bio的两个基因疗法——eli-cel(CALD)与beti-cel(β地中海贫血和镰状细胞病)也在等待审批决定,其均已受到专家委员会的支持。此外,Amicus Therapeutics的新一代庞贝氏症药物组合疗法AT-GAA、BMS的银屑病新药deucravacitinib与两大国产PD-1单抗等也值得关注。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






