集采引发一致性评价热度迫降?
发布时间:2022-06-23 11:06:57作者:本报特约撰稿 边界来源:医药经济报
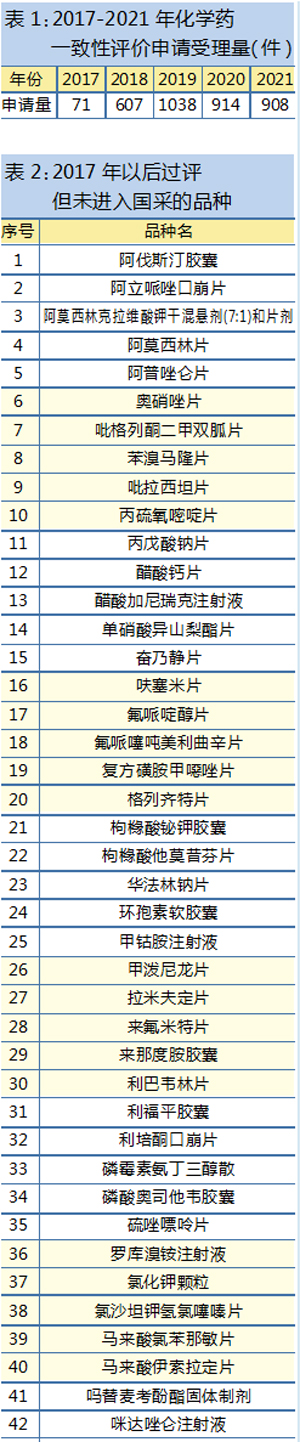
根据6月1日最新出炉的《2021年度药品审评报告》数据,自2017年化学药一致性评价申报启动以来,2019年一致性评价申报达近五年最高峰,为1038个受理号,之后逐年下滑,2021年申报数为908个(见表1)。
从咸达药海数据2022年前5个月搜集到的申报情况,结合企业申报意愿情况分析,以及北京、上海等地疫情因素,笔者推测,2022年一致性评价申报数量将进一步下滑至800个以内。
一致性评价申报数量下降,意味着厂家对通过一致性评价(以下简称“过评”)的态度从“积极”转向“理性”。
两大利好曾引申报热潮
国务院《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)提到,通过一致性评价的药品,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。随着2017年年底第一批产品过评,各省在2018年通常以“直接挂网、临床替代、医保优惠”的政策优待当时的过评产品。
2018年国务院《关于改革完善仿制药供应保障及使用政策的意见》(国办发〔2018〕20号)对过评产品主要带来两大利好:
一是加快仿制药对原研药的替代:“加快制定医保药品支付标准,与原研药质量和疗效一致的仿制药、原研药按相同标准支付”以及“药品集中采购机构要按药品通用名编制采购目录,促进与原研药质量和疗效一致的仿制药和原研药平等竞争”。
二是婉转表达过评药品可在各省挂网采购:“对于新批准上市的仿制药,相关部门应及时编制公立医疗卫生机构药品采购编码,对应的通用名药品已在药品采购目录中的,药品集中采购机构应及时启动采购程序;对应的通用名药品未在药品采购目录中的,自批准上市之日起,药品集中采购机构要及时论证,积极将其纳入药品采购目录”。
2018年2月起,上海、陕西、江苏、宁夏、内蒙古、辽宁、山西、湖北、浙江、青海等多个省(区、市)发出针对过评药品采购的具体方案或意见,其中“对通过一致性评价药品(含视同通过),均可由生产企业自愿申请在省药械采购平台挂网,纳入在线交易范围,交易价格由医疗机构或采购共同体与生产企业直接谈判确定”基本是各省方案都涵括的条款。
2018年的利好政策让行业启动一致性评价的热情高涨,一些产品存在过热申报。
集采降价利薄或亏损
2019年医保局针对已通过一致性评价的产品启动了“4+7”和“联盟扩面”试点,最后形成国家集采的机制,或是企业启动一致性评价从“积极”转为“理性”的一个关键点。
2019年国务院发布《国家组织药品集中采购和使用试点方案的通知》(国办发〔2019〕2号)提到,按照试点地区所有公立医疗机构年度药品总用量的60%~70%估算采购总量,进行带量采购,量价挂钩、以量换价,形成药品集中采购价格,签订带量购销合同。剩余用量,各公立医疗机构仍可采购省级集采的其他价格适宜的挂网品种。
为了争夺国家集采年度药品总用量的60%~70%,过评厂家杀价甚至到了“地板价”。国家集采对多家竞争产品的杀伤力最大,竞争厂家越多的产品降价越狠。如氨氯地平,2018年未通过一致性评价时5mg/片价格为1元以上,到2019年集采后每片不到0.1元。参与竞争的生产厂家为了过评,普遍投入1000万元以上,但1000万元的投入换来的是降价到薄利甚至亏损的中标资格。
挂网政策“停停走走”
实际临床使用时,上文提到的“各公立医疗机构仍可采购省级药品集中采购的其他价格适宜的挂网品种”迟迟未见兑现。可以看出,政策还是引导医疗机构和临床医生使用集采中选的产品。
大部分专利过期原研药厂家选择挂网采购而不参与集采。过评仿制药如果走集采路径,基本上价格远远低于专利过期原研药。而医保支付价的相关政策“与原研药质量和疗效一致的仿制药、原研药按相同标准支付”也迟迟未能实施。
国家集采启动后,鉴于《国家组织药品集中采购和使用试点方案》提到“根据每种药品入围的生产企业数量分别采取相应的集中采购方式:入围生产企业在3家及以上的,采取招标采购的方式;入围生产企业为2家的,采取议价采购的方式;入围生产企业只有1家的,采取谈判采购的方式”,各省的挂网政策也随之停滞。
2020年《国务院办公厅关于推动药品集中带量采购工作常态化制度化开展的意见》(国办发〔2021〕2号)公布,提到过评药品优先纳入采购范围。符合条件的药品达到一定数量或金额,即启动集中带量采购。医保局明确,过评药品上市许可持有人(含原研)数量在3家以上触发集采。
而在未达到触发门槛数量前,过评药品又可以挂网采购了。2021年,各省又陆续重新放开了对过评药品的挂网政策。
过评遇三年销售停滞
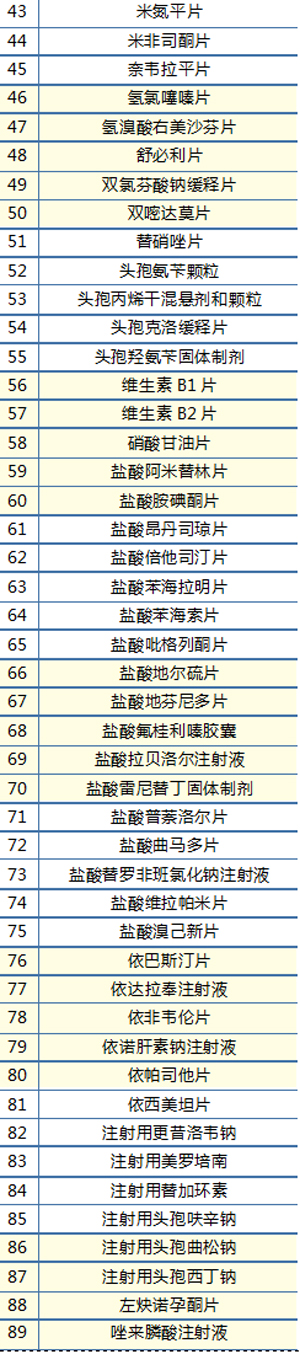
而对于2017-2021年过评但未进入国家集采的产品来说,有3年的销售停滞期,既挂不了网,又没有机会进入国采,没能享受到“通关”一致性评价带来的政策利好。这样的情况涉及89个产品(如表2)。若按每个企业每个产品600万元的投入计算,超过5亿元投入的过评药品没有得到政策理想状态的回报。
2022年,集采启动门槛再一次提升,过评药品上市许可持有人过评数量在4家以上才启动集采。
地方落地带不确定性
2021年以来,各省虽然可以启动挂网了,但各省政策不一。
福建、黑龙江、河北、湖北等省份没有明确的产品挂网周期,不能随时挂网。
北京、重庆、广东、广西等地参考全国最低价,如果是没有原研的过评药品,要参考未过评产品的最低价。这意味着过评药品虽质量提升,但价格没有提升。
上海、陕西、甘肃、四川、浙江等省(市)则是需要别省挂网、并挂网到一定程度才可以挂网。
以上政策使得过评产品快速挂网难度很大。而且就算挂网,同一产品不同厂家的挂网价格差异也很大。
地方政策落地的不确定性,导致企业对一致性评价政策利好没有信心。除了价格激励政策的不确定性,“同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种”的政策在各省执行也不到位,经常有政策滞后的现象。
政策利好还包括,“通过一致性评价药品生产企业的技术改造,在符合有关条件的情况下,可以申请中央基建投资、产业基金等资金支持”。对此,各地虽提到一致性评价获批有政策扶持,但不少企业反映,该政策的资金迟迟未到位。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






