特有品种潜水久等过评
发布时间:2022-06-02 11:12:05作者:本报特约撰稿 边界来源:医药经济报
5月份一致性评价获批平均历时14.2个月
相较于2022年4月获得一致性评价的批件从申报到审批平均历时15个月,2022年5月获得一致性评价的批件从申报到审批平均用时14.2个月。然而,这个数据是针对成功获批的产品来说的,未获批、在排队的产品也许等待的时间会更长。
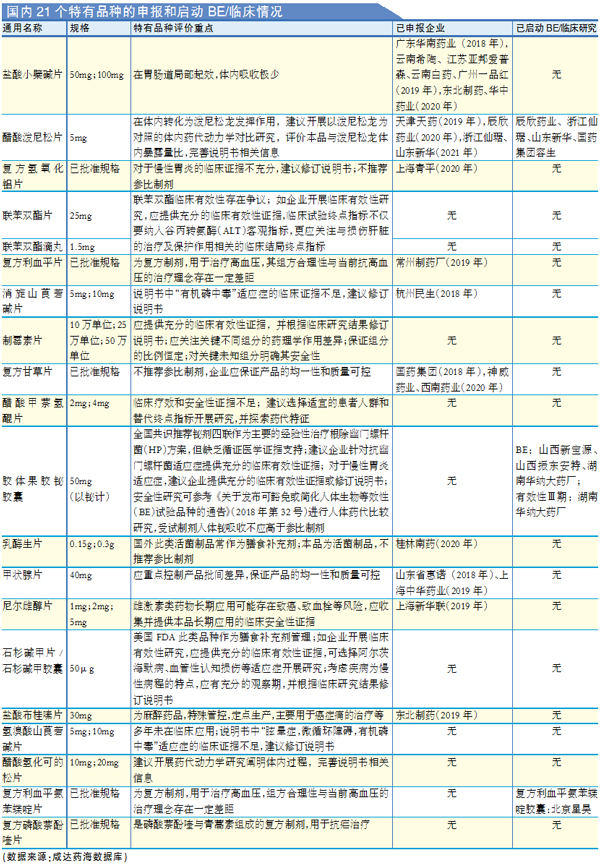
2019年6月,CDE发布《国内特有品种评价建议》,公布了289基药目录中共21个国内特有品种的评价建议,基本上每个产品都要求“应满足相关指导原则研究和评价要求”。
截至2022年5月28日,这21个国内特有品种暂无一个获批。虽然盐酸小檗碱片、消旋山莨菪碱片、复方甘草片和甲状腺片早在2018年就已申报,但是,目前除了消旋山莨菪碱片已有审批结果批件(大概率不批准)外,其余都还在审评审批阶段。这些产品成为目前一致性评价在申报产品中长期等候的一大类别。
临床研究动力不足
需要开展临床有效性研究的产品如联苯双酯片、联苯双酯滴丸、制霉素片、醋酸甲萘氢醌片、胶体果胶铋胶囊、石杉碱甲片、石杉碱甲胶囊,除了胶体果胶铋胶囊已有湖南华纳大药厂启动有效性临床试验外,其余产品都没有企业启动相关研究。这说明,临床证据不足的产品,如果没有启动临床后的利益保证,或者没有确定多久不启动临床研究就面临批文被取消的压力,那么企业启动临床研究就会动力不足。
国内21个特有品种暂无产品获批一致性评价,这意味着这些产品的批文将长时间不会受一致性评价的政策影响,从而避免来自医疗机构限用和未来批文不予再注册的压力;另一方面,也意味着已经投入一致性评价研究费用的企业,有可能得不到回报。
特有改剂型启动难
国内特有品种如何启动一致性评价一直是业界争议的话题。本文提到的成分本身特殊的是其中一类特有品种。
特有品种还包括国内特有的改剂型产品,其中最大的争议就是原研是小水针的产品,国内改剂型为粉针的产品如何做一致性评价?没有粉针的参比制剂可否参照小水针做研究,还是需要启动临床研究?
上市后竞争力存疑
这些产品未来如何在医疗机构使用也是存疑的。
一方面,如果同医保合并剂型的产品通过一致性评价的厂家数3家及以上,医疗机构会优先使用通过一致性评价的产品,而且这些产品很难与通过一致性评价的产品在集采中竞争,只能与未通过一致性评价的产品死磕价格。
另一方面,医院用药限制“一品两规三剂型”。“一品两规”指同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类似的复方制剂1~2种,因特殊诊疗需要使用其他剂型和剂量规格药品的情况除外的原则。“三剂型”多是地方自行补充的附加条件(如福建省),是指药品使用选择中,除注射、口服两种常用剂型外,根据专科或临床需要额外补充使用一种剂型(如部分儿科、皮肤科等专科,需要补充外用、儿科专用剂型)。
在“一品两规三剂型”的要求下,如果特有品种不能通过一致性评价,医院通常也会优先选择过评的剂型,特有品种的剂型就会变成次选,甚至可能变成不选了。
讨论<<<
无参比制剂产品过评,有无激活迹象?
国内特有品种的一致性评价如何获评,目前仍然处于“摸着石头过河”的阶段。
2022年1月,左氨氯地平没有参比制剂获评,或许给业界一个新的思路和方向。
但是,获评的产品有可能成为参比制剂,为别的厂家的仿制提供了可能性,也倒逼首家上市的企业要在三年内启动一致性评价。
值得关注的是,如果只有一家获批一致性评价,那么就只能挂网,而不能采用国家集采的规则占据原有企业的市场,企业还需要营销能力去获得市场。
综合多方面的因素,会启动国内特有品种的一致性评价的企业短期内不会太多,除非启动临床研究后有相对应的数据保护期等政策激励。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






