FDA加速批准“刹车”进行时
发布时间:2022-05-30 11:32:34作者:李相来源:医药经济报
美国FDA加速批准(Accelerated Approval)政策于1992年为应对HIV/AIDS危机而制定,最早通过该途径批准的药物是罗氏的抗病毒逆转灵酶抑制剂Hivid(zalcitabine,扎西他滨),从1991年10月31日监管机构受理到1992年6月19日获得加速批准,历时7.6个月。如今该途径已被FDA在多个疾病领域用于加快药物的批准上市
加速批准计划的实施,让监管机构更早批准治疗严重疾病的药物并根据替代终点满足未满足的临床医疗需求同时,也让申请者可以使用替代终点大大缩短获得FDA批准药物所需的时间。这一似乎多赢的局面如今正面临严峻挑战。
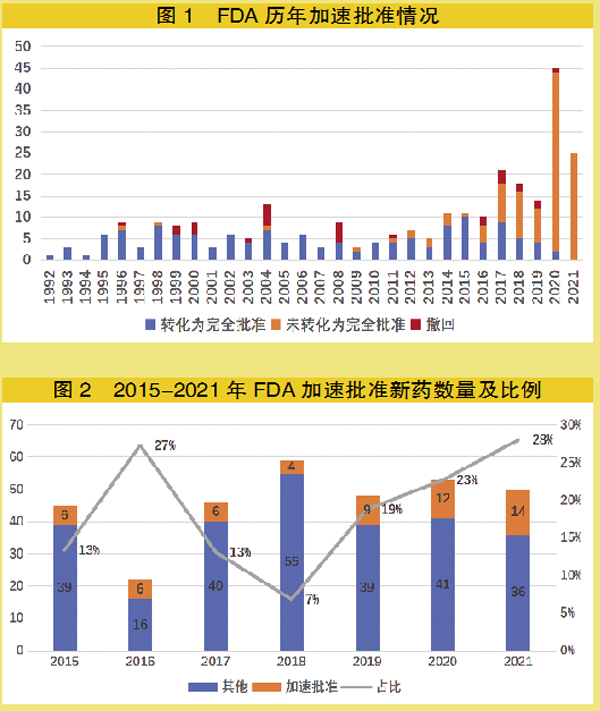
加速审批情况
据统计,截至2021年12月31日,FDA共批准了278项加速批准申请,其中138项加速批准已完成验证性试验并获得FDA完全批准(50%);28项撤回(10%);112项获批后尚未转化为完全批准(40%)。
通常,FDA对新药的标准审批时限(受理到获得批准)是10个月,而在FDA批准的278项加速批准申请中,平均审批时间为7.9个月,近五年(2017-2021年)这一数字更是降低至6.6个月。审批时间不超过6个月的有167项,占比达60%;审批时间不超过10个月有230项,占比达83%。
1992-2001年,在FDA加速批准实施的最初10年,药品平均审批时间为7.6个月。
2002-2011年,平均审批时间为10.2个月,主要受到部分产品超长审批事件拖累,如FDA于2011年历时57.5个月批准BIRTH公司早产预防药Makena(hydmxyprogesleroneca-
proate,己酸羟孕酮),创造加速审评最长审批时间记录,尽管该药上市后广受争议,但目前仍在市场销售(2019年FDA专家小组因质疑该药有效性以9票对7票建议撤出市场)。
2012-2021年,平均审批时间这一数字降低到6.9个月,与近年来以默沙东Keytruda(pembrolizumab,帕博利珠单抗)为代表的PD1类药物快速获得多项加速批准有关。
三大争议不断
FDA加速批准在快速发展之时,也越来越受到争议。而在去年6月FDA加速批准渤健的阿尔茨海默症新药Aduhelm(aducanumab)上市,更是让该政策质疑声达到顶峰。如今这项FDA备受争议的加速批准政策,可能会在重重压力之下开始“纠偏”。
正在被滥用
美国华盛顿特区非营利组织国家健康研究中心主席戴安娜·祖克曼(Diana Zuckerman)说,加速批准计划越来越受欢迎,标志着其偏离了最初的意图。
据统计,通过加速批准途径获批上市的新药比例越来越高:2021年,FDA批准的50种新药物中有14种(28%)使用该途径,回看往年数据,确实是逐年攀升,2020年12种/53种(22.6%)、2019年9种/48种(18.7%)、2018年4种/59种(6.7%)。
戴安娜·祖克曼进一步表示:“加速批准最初是针对少数药物的一项特殊计划,现在大多数抗癌药物正在通过加速批准途径。”截至目前,FDA加速批准肿瘤药物申请167项,其中近10年批准数量达到了117项(占比70%),是此前20年的两倍多。
转化周期慢
通过加速批准途径获批新药的制药公司在进行作为批准程序一部分承诺的后续研究方面进展缓慢。
在138项加速批准已完成验证性试验并获得FDA完全批准中,从加速批准到转化为完全批准平均时间长达4年多(为48.5个月),超过5年的达到60项(43%)。其中健赞公司的法布里病药物Fabrazyme(agalsidase beta)更是耗时近18年才转化为完全批准(214.7个月)。
FDA强制制药公司提供数据的权力有限,美国联邦立法者试图修改药物获得批准的这一流程并进行立法提案,以赋予FDA更多权力。
华盛顿特区的非营利性组织“患者负担得起的药物”的主席大卫·米切尔(David Mitchell)也是FDA审查抗癌药物的独立委员会的消费者代表说:“制药公司并没有按照预期使用这条加速审批的路径(继续后续研究),相反,太多的制药公司更愿意想方设法地寻找加速审批程序的漏洞,进而利用漏洞。”
撤回机制不完善
此外,加速批准后药物的撤回也广受诟病。总计28项撤回药物从加速批准到撤回平均耗时87.1个月,撤回时间超过8年(96个月)的占了一半。其中涉及到肿瘤药物加速批准后撤回18项,占总撤回数量一半以上(64%)。
去年以来,以PD(L)1类药物加速批准适应症撤回事件备受关注。仅在2021年,该类药物加速批准适应症撤回事件就有5项:默沙东Keytruda的1项,百时美施贵宝Opdivo(nivolumab,纳武利尤单抗)的1项,基因泰克(罗氏)Tecentriq(atezolizumab,阿替利珠单抗)的2项,阿斯利康的Imfinzi(durvalumab,度伐利尤单抗)的1项。不过,更多的加速批准撤回是企业自主行动,FDA在其中的作用有限。
负责监督药物安全和生物医学研究的美国众议院能源和商业委员会于今年5月宣布,希望赋予FDA更大的权力,即如果一家制药公司未能在合理的时间内完成后续研究,FDA能够撤消通过加速审批上市的药物。这项拟定中的条款,将作为FDA资金重新授权法案的一部分,有望在9月前通过。
链接<<<
谁赞同?谁反对?
美国罕见病组织(NORD)总体上是支持加速批准计划的。在其看来,当前对加速批准计划的争议会危及新药进入市场,尤其是当保险公司像对Aduhelm那样强烈地抵制新药时。与此同时,在俄勒冈州,该州的医疗补助计划已经发出请求,准许在某些情况下拒绝为加速获批的产品提供保险。NORD政策和监管事务副总裁Heidi Ross认为,针对上市之后的验证性试验以及有关它们的透明度还有很多工作要做。建议让制药公司更加频繁地出具报告,并建议FDA公开这些文件资料。
美国药品研究和制造商协会(PhRMA)则认为,没有必要进行改革。该协会一位发言人认为,美国生物制药研究公司一直致力于向患者提供安全、有效和高质量的创新疗法,就像批准所有的其他药物那样,加速审批路径也必须满足相同的安全性和有效性标准。
非营利性消费者权益倡导组织Public Citizen的健康研究小组主任Michael Carome说,验证性试验确定一个最后的期限是完全必要的。他表示,这些研究通常起步缓慢,并且不能在所计划的截止日期之前完成研究工作,即使它们最终真的完成了,赋予FDA更大的权力,以下令从市场上撤回药物,这可能是向前迈出的重要一步。
美国临床肿瘤学会(ASCO)表示反对,因为抗癌药物试验通常是基于疾病进展或死亡等事件,而不是基于患者接受治疗的时间。ASCO首席医疗官Julie Gralow说:“我不希望它基于一项研究何时将计划报告结果”。(编译/王迪)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






