供需高落差 儿药正攀登
发布时间:2022-05-30 11:29:50作者:孙权 张方(沈阳药科大学)来源:医药经济报
透视我国儿童化药和生物制剂现状
工信部、发改委等九部委联合发布的《“十四五”医药工业发展规划》,强调在“十四五”期间要强化儿童短缺药品的保障工作,加强临床急需品种的开发和引进。近年来,我国愈发重视儿童用药供应保障工作,已下发的儿童用药相关政策文件覆盖药物研发、上市、准入等阶段,全方位鼓励儿童用药研发和上市,丰富国内儿童药物品种,补足临床用药短板,保障儿童用药安全。
从政策支持和人口学特征来看,我国儿童用药市场需求迫切,具有良好的发展潜力。第7次全国人口普查数据显示,2020年中国0~14岁人口数约为2.5亿,占全国总人口的17.95%,与2010年相比上升1.35个百分点。不过,总体来看我国儿童用药市场现状并不乐观,不少问题亟待多方合力解决。下面对儿童化药与生物药状况进行阐述。
专用适用品种少,治疗领域偏集中
国内儿科专用产品的批准文号和有效活性成分数量均较少,远远满足不了全国2.5亿儿童人口对安全有效的儿童用药的迫切需求。全国工商联数据显示,截至2019年我国药品生产企业达6000余家,其中专业生产儿童用药的企业不足10家;生产儿童用药但非专业生产儿童用药的企业不足30家,且很多为外资企业;我国3500余种化学药品制剂中,专供儿童使用的品种不足百种,占比不到2%。此外,我国仍有成人用药减量用于儿童临床用药的现象,儿童口服片剂93.3%需要拆分使用,且多数儿童用药是成人药的“减量版”,只在用量上进行了儿童适应性调整。
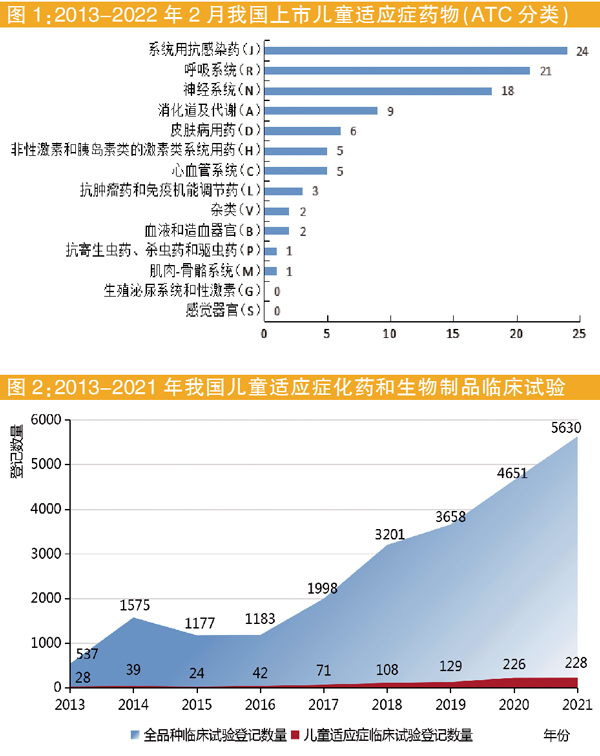
疾病就诊占比与药物需求量呈正相关。通过药智网药品临床试验、研发、注册和上市数据,对2013年至2022年2月在药审中心注册并开展临床试验的儿童适应症药品以解剖学、治疗学及化学分类法(Anatomical Therapeutic Chemical,ATC)分类来看,近年上市的97种儿童用药涵盖12个ATC大类,前三位为:系统用抗感染药24种;呼吸系统用药21种;神经系统用药18种。
将已上市儿童用药品种占比与儿童易患疾病占比进行比较后发现,在儿童用药整体供给不足的情况下,消化道及代谢类药物品种缺乏尤为明显。上市药品分布趋势与儿童易患疾病种类大体一致,但感觉器官、生殖泌尿系统和性激素类药物尚无上市品种,急需新药上市补充临床用药需求。此外,重症专科疾病、罕见病等领域治疗用药同样存在短缺现象,需要引起足够重视。
临床试验机构缺乏,知情同意签署难
截至2022年1月底,国家药监局三批鼓励研发申报儿童药品清单的104种药物中,有55种药物没有厂家申报仿制和登记临床试验,大量儿童临床急需品种在国内仍无药可用,儿童使用成人药物和超说明书用药看似有悖合理用药原则,但也是无奈之举。
从试验进展来看,随着我国相关部门接连推出儿童用药研发的利好政策,我国儿童药品临床试验登记数量呈逐年增长趋势,2013年至2022年4月底共收到儿童适应症的化药和生物制品临床试验登记1013个(其中Ⅲ期临床试验67个),但已完成的临床试验数量仅有467个(完成率46.1%),Ⅲ期临床试验16个(完成率23.9%),完成率过低。
从已通过临床试验并成功上市品种占该ATC分类临床试验总量比重来看,各分类药品的上市数量均未超过临床试验总量的半数。值得注意的是,消化系统疾病是目前儿童高发病,但其上市数量和占临床试验比重均不理想;随着儿童生活条件日益优越,儿童性早熟疾病的问诊频率增速明显,但目前临床暂无上市品种,临床试验仅有1例;感觉器官用药既无上市品种,也没有相关临床试验,值得研发机构和药品审查相关部门关注。
临床试验机构缺乏是导致儿童用药临床试验开展困难的原因之一。儿童药品因患者人群的特殊性,处方更复杂,工艺要求更高,药品的安全性、有效性等监管力度较成人用药更为严苛,对临床试验机构的资格认定标准更高,进而导致我国具备儿童用药临床试验资质的机构很少。有数据显示,截至2022年1月,通过我国资格认定或复核检查的药物临床试验机构共有1210家,其中仅有215家机构具有儿童专业,占比17.77%。
此外,儿童作为弱势群体,参加临床试验需要首先征得监护人同意,家长对临床试验认识差异较大。有些家长在有标准治疗方案或替代治疗方案的情况下,选择参加临床试验的意愿较低,知情同意难。这就导致儿童用药临床试验受试者招募困难,试验周期长,招募周期往往是成人临床试验的1倍有余。
投资回报率过低是儿童临床试验数量少的另一个原因。多数非专营儿童用药的药企不会将主营业务放在儿童用药领域,儿童用药研发投入往往低于10%。以强生为例,除扩展适应症药物外,婴儿护理、儿童相关药品和大健康产品占强生2021年938亿美元营收的比例不超过7%。此外,仿制药会面临国家和地方集采的风险,一款成人仿制药的研发费用一般为1500万~2500万元,而儿童用药要进行剂型重塑、口味优化等一系列儿童偏好研发,导致研发成本成倍增加。随着我国集中采购进入常态化,本就对儿童用药持观望态度的药企对儿童用药市场更是敬而远之。
因此,要想改变儿童用药临床试验少、进展缓慢的难题,需要有更多的临床试验机构,这就要求资格评定部门对机构进行综合评估,对有潜力的机构进行相关培训,以符合标准;对于儿童用药而言,安全性是第一要义,但受试者招募困难也是公认的问题,建议监管部门根据具体情况,允许采用真实世界数据或其他间接证据附条件上市,并监测上市后的临床使用情况,进行动态调整。
对于儿童用药研发投资回报率过低的问题,可以从多部门寻求解决方法:药监部门对研发阶段的药品提供技术支持和政策指导,可考虑将所有儿童用药纳入优先审评审批名单中,通过让企业少走弯路和缩短审评时间来降低研发阶段的投入;医保部门对儿童用药开展合理的临床综合评价,基于药物的真实价值制定支付标准。鉴于儿童用药的稀缺性和庞大需求,可以对儿童用药实行按病种付费、年度订购合同付费等DRG/DIP支付体系外的付费机制,还可以对相关企业授予专利独占权及市场保证,确保企业对儿童用药的市场前景有清晰的预估,增强其研发积极性。
化药多为仿制,生物制剂仅有10种
通过药智网中国上市药品数据可知,截至2022年2月,完成临床试验并以儿童适应症上市的化药和生物药品种仅80个,其中有70个化药品种(87.5%),10个生物制剂(12.5%)。
化学药中,已上市的1类(未在境内外上市的药品,2种)、2类(境内外均未上市的改良型创新药,5种)和5类(在境外上市的,申请在境内上市的药品,17种)的化学新药仅有24种,占国内上市儿童适应症品种总数的30.0%。
可见,近年来国内上市的儿童化药品种多为仿制药,新药占比不到一半。化学药多存在耐药性问题,因此需要及时更新作用靶点和起效途径,这加大了临床对新药的需求。鉴于我国上市化药品种中新药占比过少,相关部门应该将化学新药作为下一步鼓励研发的重点。
生物制剂相比于化学药具有药理活性更高、毒副作用更小、营养价值更高等优点,儿童人群使用更加安全。但截至今年2月,国内上市的生物制剂数量仅有10种,仍无法满足儿童安全用药需求。生物制剂需利用生物体、生物组织、细胞、体液等制造,研发成本和研发周期远高于化学药。因此,想要提高国内市场的生物制剂品种数量,需要在资金和审评通道等方面对研发机构和相关企业给予足够的支持,鼓励生物制剂的研发上市。
☆☆★结语★☆☆
冰冻三尺非一日之寒。国内儿童用药品种过少有许多原因,扭转该局面需要药企、研发机构、监管审查部门、医保部门和采购部门等多方共同参与。各相关部门应加深与药企的有效沟通,听取真实声音,积极调整政策,基于市场需求给予方向引导。
近年来,在国家多部委鼎力支持儿童用药开发的良好环境下,我国儿童药物临床试验登记数量有明显增长,这让我们看到了儿童用药市场破冰的可能性。解决儿童用药短缺、促进儿童合理用药,对保障我国儿童健康成长、加快推进“十四五”医疗保障规划和“健康中国2030”建设目标具有重要且长远的意义。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






