Jak“枪”致力精准命中免疫靶
发布时间:2022-05-05 14:09:20作者:李勇来源:医药经济报
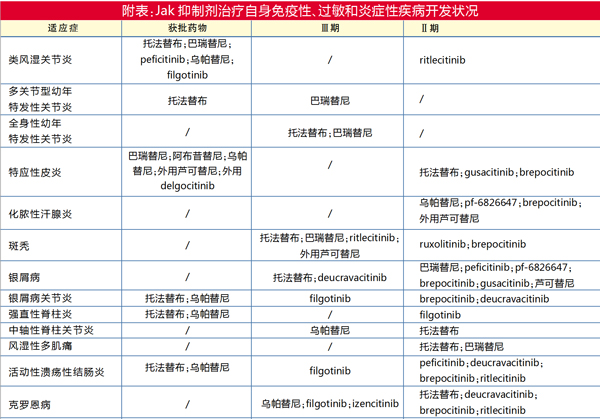
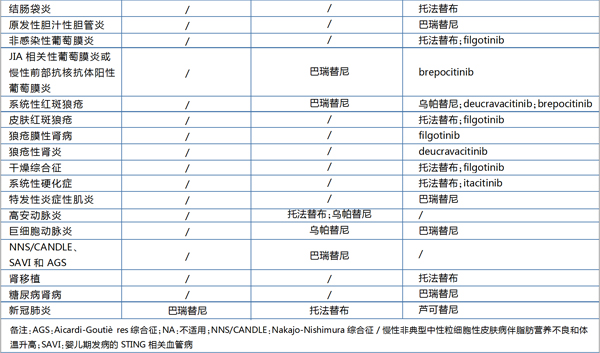
细胞因子在免疫和炎性疾病的发病机制中具有关键作用,并且可以作为新药开发的靶点。譬如近年来抑制Janus激酶(Jak1、Jak2、Jak3和Tyk2)蛋白(作用于促炎细胞因子下游的基本信号传导介质)的靶向小分子疗法,已成为治疗类风湿性关节炎、脊柱关节炎、银屑病、特应性皮炎和炎症性肠病等自身免疫性疾病的有效选择。
Jak之兴起
诺华/Incyte的Jakavi(ruxolitinib,芦可替尼)是全球首款获批上市的Jak抑制剂(2011年11月获FDA批准),但其获批适应症为骨髓纤维化,随后几年又获批其他3种适应症:成人真性红细胞增多症、急性移植物抗宿主病和慢性移植物抗宿主病。
然而在竞争激烈的肿瘤领域,芦可替尼并没有引起太多波澜。值得一提的是,今年2月CTI BioPharma的Jak2/Irak1/Csf1R抑制剂Vonjo(pacritinib,帕克替尼)也获得FDA上市批准,用于治疗伴有严重血小板减少症的骨髓纤维化患者。
2012年11月辉瑞Xeljanz(tofacitinib,托法替布)获得FDA批准用于治疗中度至重度类风湿性关节炎,才真正开启了Jak抑制剂在自身免疫疾病开发的热潮。
在注射生物制剂主导的自身免疫疾病领域,托法替布通过口服给药大大提高患者用药便利性。更重要的是,托法替布突破了疾病领域的机制限制,进而成为拥挤抗风湿药市场中,改变游戏规则Jak抑制剂中的第一个。
随后,托法替尼获批用于银屑病关节炎、强直性脊柱炎、溃疡性结肠炎和多关节病程幼年特发性关节炎等多种自身免疫疾病的治疗。
在辉瑞托法替布带领下,目前已有多款Jak抑制剂在全球主要监管机构获批上市用于多种自身免疫性疾病相关适应症的治疗,比如礼来/Incyte的Olumiant(baricitinib,巴瑞替尼)和Rinvoq(upadacitinib,乌帕替尼)等。
早期上市的托法替尼、巴瑞替尼是泛Jak抑制剂,意味着其会靶向多种Jak家族激酶,例如Jak1、Jak2、Jak3和酪氨酸激酶2(Tyk2),上市后临床应用发现其引起机会性感染、淋巴瘤等癌症、肺栓塞风险和死亡率等风险增加。因此,该类药物上市后屡屡遭遇监管机构的安全警告,而同类新药/新适应症的申请也多次遭遇延期或者更严格审查。
与托法替尼、巴瑞替尼相比,尽管Jak1选择性抑制剂乌帕替尼因靶向性更强被认为具有更好的安全性,但由于其共同作用机制(MOA),亦不能免除监管方面的忧虑。
新一代“避险”
随着Jak抑制剂类药物安全问题的不时出现和其在免疫疾病领域管线继任者的增加,新一代Jak抑制剂的开发势在必行。生物制药公司正在通过选择性抑制特定受体或将其递送到与疾病相关的特定区域,以尽量减少不良事件并避免此前应用中出现的监管安全性警告。Tyk2抑制剂被认为是理想的机制之一。生物制药公司寄希望于该靶点不同的细胞信号通路作用,最大程度地减少潜在的副作用并使其药理作用最大化。
作为Tyk2抑制剂的领航者,百时美施贵宝开发的deucravacitinib(BMS-986165)治疗成人中度至重度斑块状银屑病的新药上市申请目前已被FDA和EMA受理。
作为Jak抑制剂的重要参与者,辉瑞此前开发有2款Tyk2靶点的药物:Tyk2/Jak1抑制剂brepocitinib(PF-06700841)和Tyk2抑制剂PF-06826647,涉及多项适应症,并且进入了Ⅱ期临床试验。然而,2021年11月辉瑞将其Tyk2投资组合出售给一家新公司,退出了Tyk2抑制剂的竞争。
Tyk2亦存在Jak类安全问题
与此同时,Tyk2抑制剂在免疫学领域的前景同样存在着广泛不确定性。
尽管百时美施贵宝一直强调deucravacitinib与Jak类药物的差异: deucravacitinib具有非常特定的下游效应,可以调节IL-12、IL-23和干扰素,并保留其他细胞因子和Jak1、Jak2、Jak3,但问题仍然是新一代选择性Jak抑制剂的靶向性质是否会限制药物的疗效,并且安全性可能仍得不到实质性改善。最重要的是,打消监管机构的疑虑困难重重。
与此同时,也有开发者尝试其他方法靶向递送Jak抑制剂,以期抑制其口服给药出现的不良反应。例如,制药公司将Jak配制成用于皮肤病的外用乳膏。然而,迄今为止,这种更有针对性的方法未能避免Jak类的安全问题,如芦可替尼局部外用制剂在2021年9月获得FDA批准用于特应性皮炎,但同样收到了Jak类效应的黑框警告。
正在开发的几类与Jak类似的新型激酶,包括布鲁顿酪氨酸激酶(BTK)、白细胞介素1受体相关激酶(IRAK)和盐诱导激酶(SIK)也出现了类似情况。这些药物旨在通过更高的特异性靶向免疫途径,实现减轻潜在不良安全事件的效果,同时在一系列免疫疾病中实现广泛的疗效。然而,在迄今为止达到疗效终点的情况下,该类药物一直存在诸如高感染率和剂量限制性毒性等安全信号缺点。
监管力度差异化
激酶抑制剂在治疗免疫疾病时重复出现安全问题,意味着该领域的药物开发者不得不考虑未来包括FDA在内的监管机构处理免疫学激酶抑制剂的监管决策,以及他们是否会孤立地考虑每种药物的数据或类似于Jak的类别效应。至少从目前来看,FDA采取了Jak类别效应来审查该类药物。
然而,FDA的监管策略不一定适用于全球。鉴于巴瑞克替尼缺乏额外的监测要求,EMA迄今为止采取了更加个性化的方法,欧洲监管机构是否会继续采取更具体的产品方法来为新的选择性Jak和Jak类似疗法应用警告标签,还有待观察。
未来有挑战
展望免疫领域激酶药物的未来,前进的道路绝非一帆风顺。随着越来越多新一代Jak和Jak类似疗法进入市场,一些因素将成为决定这些药物能否成功的关键。
首先是监管机构对药物的看法。新一代Jak抑制剂和Jak类似疗法与第一代泛Jak在临床和声誉上能够保持多大的距离和差异化还有待观察,这将是影响监管决策和临床医生治疗选择的关键因素。另外还有待确定的是:替代给药途径(例如,用于皮肤病学的局部外用Jak制剂)在多大程度上可以帮助改变以前对Jak抑制剂的认知,甚至帮助该类剂型甩掉Jak安全问题包袱并推动其取得成功?
其次是药物能否达到必要的疗效终点。特别是对于选择性的新一代Jak抑制剂,这些疗法是否通过更有靶向性的机制对安全性进行了过度评价而损害了疗效,这将是一个重要的问题。因为药物开发者希望建立跨免疫学应用,能否在不同适应症都取得成功还难以保证。
最后是欧美监管机构态度产生的影响。监管机构的不同决策将会影响该类药物的临床治疗地位,并要求开发者在每个地理区域定制商业策略,以考虑不同的竞争格局和随后的临床试验对照药以及定价和市场策略。
虽然制药行业对Jak抑制剂适应症有很大的兴趣,而且临床对这类药物也有需求,但药物相关的监管、准入和临床优势的不确定性和不利因素不能忽视。只能说,Jak抑制剂在免疫学领域机会依然存在,那些能够通过谨慎的商业开发和规划来引导和抓住机会的创新者才有机会大放异彩。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






