RAS靶向疗法分兵曲线突围
发布时间:2022-04-20 10:47:22作者:李勇来源:医药经济报
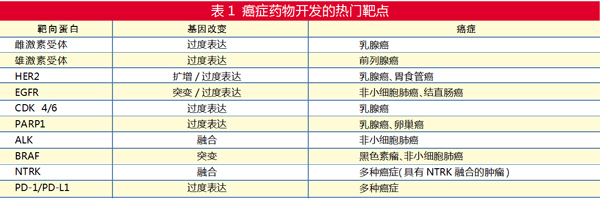
4月15日-21日是全国肿瘤防治宣传周,今年的主题是“癌症防治早早行动”。近年来,包括抑制癌症驱动基因在内的靶向治疗药物极大地改善了多种不同癌症类型患者的预后。然而,数据显示,在已确定的大约700个癌症基因中,目前大概只有40个基因对应的药物获得监管机构的批准。大多数制药公司和学术研究人员主要关注这其中十几个热门基因。
事实上,研究热门的基因中,已有多种靶向药物进入市场。例如,对于发病占15%~20%的HER2基因扩增/过表达乳腺癌,至少有7种药物获得美国FDA批准,还有多种新药正在进行临床试验。同样,对于仅占3%~5%的ALK重排非小细胞肺癌(NSCLC),也有5种药物获得FDA批准。
与这些开发了多种已上市药物的少数驱动基因相比,绝大多数的癌基因,包括一些最常被改变的基因仍然缺乏经过临床验证的治疗方法。对于这方面的研究开发,是否也该早早行动起来?
挑战“不可成药性”靶点
在人类癌症中,最常突变致癌基因RAS、最常见扩增基因MYC、最常突变抑癌基因TP53(p53)等是最常改变的基因,由于这些基因编辑的蛋白产物已被证明难以靶向,因此传统上将它们称为“不可成药性”靶点。
RAS、p53和MYC难以开发成为药物有3个原因:首先,这3种蛋白都缺乏一个易于识别的可接近的口袋(结合位点),以使潜在的低分子量药物可以高亲和力地与之结合。其次,除了RAS表现出弱的内在特性催化活性(GTPase),p53和MYC都不具有酶活性,因此不能被低分子量催化抑制剂靶向作用。最后,这3种蛋白都位于细胞内,RAS位于细胞膜内层,p53和MYC均位于细胞内。
不过,尽管存在重重困难,但随着近年研究的深入和技术突破,“不可成药性”靶点正在取得积极进展,甚至是划时代突破。
开启KRAS重大里程碑
去年5月,FDA加速批准安进(Amgen)公司开发的Lumakras(sotorasib)上市,用于治疗肿瘤携带KRASG12C突变的非小细胞肺癌(NSCLC)患者。Lumakras的批准代表着针对KRAS靶点药物开发的重大里程碑。
RAS是癌症中最常见的突变癌基因,在所有癌症中约有30%发生突变。RAS基因家族由3个成员组成,编码4种蛋白质,KRAS4a、KRAS4b、NRAS和HRAS。在RAS的3种形式中,突变最常见于KRAS(85%),其次是NRAS(12%)和HRAS(3%)。在KRAS中,几乎只在密码子12、13和61发现突变,分别对应甘氨酸12(G12)、甘氨酸13(G13)和谷氨酰胺61(Q61)。
KRAS突变在胰腺导管癌(95%)、结直肠癌(40%)和非小细胞肺癌(30%)中最常见。
靶向RAS的研究尝试已经进行了25年以上。尽管理论上,可能会发现药物可以附着在RAS中的GDP/GTP结合位点,但实际上由于这些核苷酸的结合极其紧密(皮摩尔亲和力和缓慢的关闭率)以及细胞内GTP的高浓度,不太可能开发出涉及该位点的竞争性核苷酸抑制剂。因此,针对RAS的一些尝试集中在间接策略。
1.抑制膜附着
靶向RAS的首批尝试集中在阻止其与细胞膜内层的结合,这一过程是RAS发挥功能所必需的,即异戊二烯化。异戊二烯化由法尼基转移酶(FT)和香叶基香叶基转移酶(GGT)2种酶催化。最初开发出的FT抑制剂(FTI)在几项临床前研究中显示出活性。
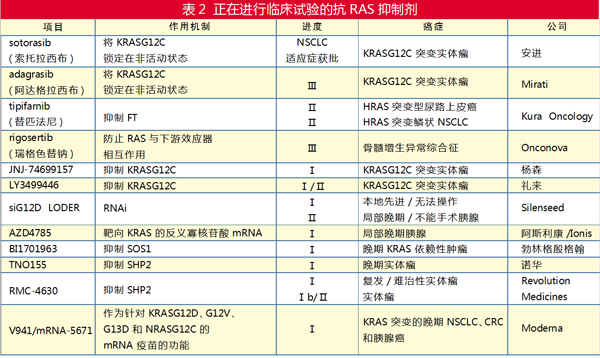
三种FTI(tipifarnib、lonafarnib和salirasib)在KRAS突变的NSCLC、结直肠癌(CRC)和胰腺癌患者中进展到Ⅲ期临床试验,但被证明在很大程度上缺乏疗效。然而,Kura Oncology开发的tipifarnib已被美国FDA授予快速通道指定,用于治疗HRAS突变头颈部鳞状细胞患者癌、复发性或难治性血管免疫母细胞性T细胞淋巴瘤、滤泡性T细胞淋巴瘤和具有T滤泡辅助表型的淋巴结外周T细胞淋巴瘤的成年患者。
2.抑制下游信号传导
另一种广泛研究的抑制RAS驱动肿瘤的策略涉及靶向下游信号传导通路。RAS通过多种途径介导下游信号传导,包括RAF-MEK-ERK、PI3K-AKT和RALGDS途径。已经针对这些途径中的特定蛋白开发了几种不同的抑制剂,尤其是针对RAF-MEK-ERK(vemurafenib、trametinib、selumetinib)和PI3K-AKT(buparlisib、apelisib)中的蛋白。然而,这些抑制剂在迄今为止测试的RAS突变临床前模型中基本上是无效的。这种缺乏有效性似乎主要是由于代偿机制,当用作单一药物时,这些机制否定了其潜在抑制能力。抑制下游信号的进一步策略包括防止RAS与其效应信号蛋白相互作用。
Onconova公司开发的苄基苯乙烯基砜类化合物rigosertib通过连接到RAS效应器(包括RAF、PI3K和RALGDS)的结合域来充当RAS模拟物。因此,rigosertib阻断了来自这些效应蛋白的下游信号。与其阻断RAS效应蛋白相互作用的能力一致,rigosertib已被证明可抑制突变RAS依赖性肿瘤的多个临床前模型的生长。rigosertib已完成或目前正在进行的临床试验有30多项。
3.直接靶向KRAS特定突变形式
尽管最初认为RAS缺乏适合结合低分子量化合物的口袋,但最近发现了几种小分子,不可逆地连接到KRASG12C突变蛋白中先前未识别的调节口袋。由于这些化合物依赖于突变的半胱氨酸残基进行结合,因此它们对野生型RAS没有可检测到的影响。然而,它们阻止核苷酸交换并将RASG12C蛋白锁定为非活性的GDP结合状态,从而阻止RAS与RAF相互作用并阻止下游信号传导。
安进的sotorasib可选择性且不可逆地抑制突变蛋白并将其锁定为非活性的GDP结合形式。该药于2021年5月率先冲过终点线,获得FDA加速批准,用于治疗肿瘤携带KRASG12C突变的NSCLC患者,目前处于遥遥领先的位置。
作为安进的竞争对手,Mirati公司的adagrasib获得FDA授予用于治疗既往接受过全身治疗的KRASG12C突变NSCLC突破性疗法认证。此外,还有多种KRASG12C抑制剂进入临床开发阶段。
尽管KRASG12C抑制剂已取得突破,应指出的是,KRASG12C突变在癌症中相对罕见(占KRAS突变的12%),存在于13%的肺腺癌、3%的结直肠癌及大多数其他类型的肿瘤中(不到2%)。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






