真实世界研究令药审有“数”更有效
发布时间:2022-04-07 16:37:45作者:李相来源:医药经济报
作为循证医学研究的后起之秀,真实世界研究日益得到各方认可,其中,有两个概念常被提及,即真实世界证据(Real-World Evidence,RWE)和真实世界数据(Real-World Data,RWD)。
RWE是指通过对真实世界数据的分析获得的关于医疗产品的使用情况和潜在获益或风险的临床证据;RWD则为与患者健康状况有关的和/或来源于各种日常医疗过程所收集的、经过分析具有潜在形成真实世界证据可能的数据。近年来,这二者对药品包括新药上市申报的监管决策有重要影响。笔者试结合新药申报案例阐述二者的作用及角色转变。
RWE
促进孤儿药审批
方法学是关键
过去,监管机构主要使用真实世界证据(RWE)进行上市后药物安全性的监管决策。例如,监管者依靠药物上市后的安全监测来收集和追踪药物可能发生的不良事件的信息;将RWE用于与药物疗效相关的监管审批决策则较为少见。
不过,美国于2016年12月通过《21世纪治愈法案》,旨在鼓励美国食品药品监督管理局(FDA)开展研究并使用RWE以支持药物和其他医疗产品的监管决策,加快医药产品的开发。在该法案的推动下,2017-2018年FDA先后发布了《使用真实世界证据以支持医疗器械监管决策》《临床研究中使用电子健康档案数据指南》和《真实世界证据计划的框架》。
作为传统临床试验的补充,真实世界证据(RWE)近年来受到越来越多的关注。使用RWE寻求FDA批准也日益常态化。
对孤儿药助力最大
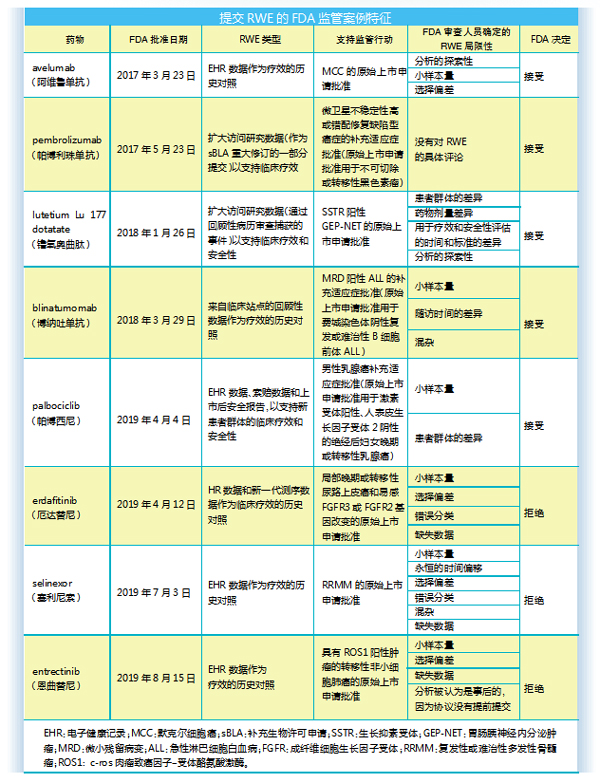
对近年部分数据分析显示,avelumab、blinatumomab、selinexor、lutetium Lu 177 dotatate、palbociclib等药物都是通过RWE获得FDA批准,使用的RWE类型包括电子健康记录(EHR)数据、索赔数据、上市后安全报告、回顾性医疗记录审查和扩展访问研究数据,lutetium Lu 177 dotatate和blinatumomab则都使用了来自美国以外的RWE数据。其中avelumab、blinatumomab和selinexor通过RWE提交的适应症获得了加速批准,后续需要提供用于验证性临床试验数据的上市后要求(PMR),avelumab和 blinatumomab则要进行新的临床试验。
诺华的Lutathera(lutetium Lu 177 dotatate)被FDA批准用于治疗生长抑素受体阳性(SSTR阳性)胃肠胰腺神经内分泌肿瘤,所依据的数据来源于随机、开放标签、阳性药物对照试验(NETTER-1)和支持RWE的回顾性、开放标签、单臂、扩大访问研究。
安进Blincyto(blinatumomab)获得FDA加速批准是基于对189名成年患者进行的Ⅱ期单臂研究(MT103-211)的结果。不过blinatumomab的单臂试验得到了历史对照组数据的支持,这些数据来自美国和欧洲研究中心接受标准化疗患者的病历审查。
通过对上述5个案例中提交新药生产上市注册申请(NDA)/生物制品许可申请(BLA)的临床试验和RWE比较表明,当临床试验没有对照或比较臂时,RWE收集的历史对照试图将患者群体与临床试验的人群相匹配;在使用比较臂进行临床试验的情况下,RWE用于扩大患者群体。在所有情况下,都试图用RWE复制至少1个临床试验终点。
值得一提的是,在5种药物中有4种被指定为孤儿药,第5种是针对较大患者群体中的一个罕见亚组(用于男性乳腺癌患者的palbociclib)。
过去十年中,FDA在批准用于罕见适应症的药物时采用RWE有重要先例:2008-2017年,42.5%批准上市的孤儿药用于肿瘤适应症。罕见病患者数量较少,这是罕见病药物进行传统随机对照临床试验(RCT)的障碍,并且罕见病严重或危及生命的性质以及未满足的医疗需求通常使该领域疗法有资格获得加速计划,例如加速批准。在这种情况下,FDA经常灵活接受罕见病药物单臂研究以支持批准:2013年至2018年间FDA批准的肿瘤适应症中有34%基于单臂试验。因此,临床安全性和有效性等方面支持审批的数据有限。此外,只有不到5%的成年癌症患者参与临床试验,其中更年轻、更健康且多样性较低的患者参与比例过高,导致数据不一定能代表整个患者群体。
或因方法和质量遭拒
不过,也有使用RWE申请被拒绝的案例,如erdafitinib、selinexor和entrectinib所提交的RWE旨在用作历史对照,但因方法问题/数据质量差而被拒绝。
新型口服选择性核输出蛋白抑制剂selinexor被FDA授予孤儿药资格,用于治疗复发难治性多发性骨髓瘤患者。selinexor最初提交的新药申请数据包括来自开放标签、单臂试验(STORM)的数据和使用来自Flatiron数据库的EHR数据的回顾性观察研究。然而,FDA发现EHR数据存在方法学问题,观察性研究的结果被认为不足以支持监管决策。因此,批准决定中没有考虑EHR数据。相反,该药获批的依据是STORM试验的数据、正在进行的Ⅲ期随机试验(BOSTON)的数据以及上市后提交的BOSTON试验最终数据。
RWD
存在一定局限
我国快速追赶
RWD可以在整个药物开发周期中以多种方式使用,可以为RCT提供有价值的补充信息。但是,使用RWD有一些限制。例如,由于RWD来源(例如电子健康档案或索赔数据)不是为临床研究设计的,因此存在潜在未观察到的因素(例如医生意见或患者要求)影响医生治疗过程的风险,这会阻止直接比较治疗组之间的结果或RCT结果。此外,常规临床实践中的患者可能不像临床试验中的患者那样受到密切监测,这可能导致报告的不良事件发生率较低。也有可能因更严重的诊断而无法捕获或记录轻微的不良事件。
不过,除FDA外,其他监管机构,如欧洲药品管理局(EMA)和日本药品医疗器械管理局(PMDA),也表示有兴趣使用RWD来支持药物监管决策或上市后监测。
国内已发布《真实世界证据支持药物研发与审评的指导原则(试行)》《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》和《用于产生真实世界证据的真实世界数据指导原则(试行)》,大大助推行业真实世界研究的热潮。
目前有企业希望利用RWD来支持药物在国家药品监督管理局(NMPA)申报注册。但实际上,真实世界研究中存在医院数据质量不高的问题,各医院目前的临床数据杂乱、非结构化,患者不固定,以至于现有数据几乎不可用。只有事先设计高质量研究方案,统一临床试验观察表(CRF)且长期追踪的前瞻队列才具有高等级的数据价值。
尽管困难重重,我们也在逐步积累经验并取得成效。如2021年4月,NMPA通过优先审评审批程序附条件批准蓝图药物公司Blueprint Medicines Corporation申报的1类创新药普拉替尼胶囊上市。该产品也是海南临床RWD应用试点品种,相关真实世界研究结果作为临床试验结果的补充,为其在中国晚期非小细胞肺癌人群中的疗效评价和安全性评估提供了辅助。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






