“试验设计”成SERD折戟之源
发布时间:2022-03-30 11:10:08作者:伊瑶来源:医药经济报
近日多款口服选择性雌激素受体降解剂(SERD)关键临床试验数据公布,从结果看不全是好消息,如赛诺菲发布公告称,经独立评审委员会(IRC)评估,其开发的口服SERD新药amcenestrant在Ⅱ期AMEERA-3临床试验没有达到改善无进展生存期(PFS)的主要终点。受此消息影响,赛诺菲美股盘前跌4.24%,报48.56美元,法股也下跌5.05%至88.89欧元。此前,赛诺菲曾声称amcenestrant为“潜在的变革性”产品,市场预计2026年的销售额为10亿美元。
SERD是一种小分子,它们通过与癌细胞表面的雌激素受体(ER)相结合,降低雌激素受体的稳定性,诱导它们被细胞正常的蛋白降解机制降解,从而降低雌激素受体水平,抑制癌细胞的生长。美国癌症协会2020年统计的数据中表明:美国每年诊断出超过250,000例乳腺癌患者,其中,近80%是雌激素受体阳性(ER+),因而SERD被认为能使更多的乳腺癌患者受益。随着研究的深入,该领域晚期项目的空间可能很快就会更加拥挤,在SERD冲刺的晚期关键阶段,谁会顺利撞线?又有谁会重蹈覆辙?开发公司如何汲取有益于其项目的经验?
试验设计决定成败
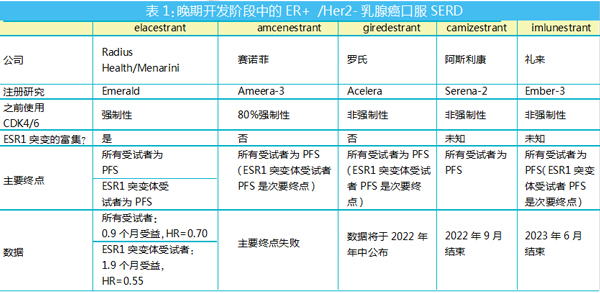
Ameera-3是一项开放标签的Ⅱ期随机试验,在激素治疗期间或之后进展的局部晚期或转移性ER+ /人表皮生长因子受体2阴性(HER2-)乳腺癌患者中,用于评估amcenestrant作为单一疗法的疗效和安全性,并与医生选择的内分泌疗法进行比较。其研究主要终点为由独立评审委员会评估的PFS;关键的次要疗效终点是总生存期;其他次要终点是客观缓解率、疾病控制率、临床受益率和缓解持续时间。
Amcenestrant在ER+/HER2-乳腺癌中未能通过此前经3次延迟的Ameera-3试验,行业分析者不禁发出质疑:可以将多少责任归咎于这个研究设计本身?随着竞争对手口服SERD的关键临床试验方法和结果的公布,这个问题越来越不容忽视。
问题1:受试者标准太严苛 细胞周期蛋白依赖性激酶(CDK)4/6抑制剂是ER+/HER2-乳腺癌患者群相对较新的治疗方法,并且正在改变目前的治疗格局,Ameera-3的设计要求至少80%的受试者是使用CDK4/6抑制剂治疗失败的患者。因此,在PFS方面,患者可能在此前接受的治疗中已获得很大的益处,这就可能导致amcenestrant试验组和氟维司群/芳香酶抑制剂对照组之间PFS的数值差异太小而无法达到统计学意义。
到目前为止,赛诺菲尚未发布有关基础数据的详细信息。Ameera-3的唯一主要终点是所有受试者的PFS。
问题2:未单列ESR1突变患者 一个更大的问题可能是赛诺菲的试验没有单列的携带雌激素受体1(ESR1)突变患者。这个说法可以从Radius/Menarini公司的elacestrant项目研究结果得到一定印证。在赛诺菲amcenestrant遭受长期延误之后,elacestrant项目于去年12月以积极的关键数据超越了amcenestrant。
Elacestrant的Emerald试验在所有受试者和ESR1突变携带者中都获得了阳性结果,但完整的数据毫无疑问地表明,正是ESR1突变组(elacestrant和标准疗法PFS中位数分别延长为3.78个月和1.87个月)推动了所有受试者(elacestrant和标准疗法PFS中位数分别延长为2.79个月和1.91个月)PFS的受益。
Emerald和Ameera-3之间的关键区别在于前者确实丰富了具有ESR1突变的患者,从而最大限度地提高了成功的机会。
赛诺菲表示,amcenestrant的两项Ⅲ期研究将继续进行,包括Ameera-5与 Ameera-6研究。不过,由于这两项研究将分别在2024年和2026年才会公布结果,因此即使取得了积极试验结果,amcenestrant也将失去曾经看起来对elacestrant来说重要的先发优势。
追赶者避免重蹈覆辙
现在行业的注意力还落在其他竞争者如罗氏、阿斯利康和礼来身上,这些公司的口服SERD晚期项目都可能超越赛诺菲获得积极的关键数据。
预计罗氏的giredestrant和阿斯利康的camizestrant进度较快,将于2022年晚些时候提供数据,其中,giredestrant的二线/三线Acelera试验可能在未来三个月内公布数据。然而,与阿斯利康camizestrant的Serena-2试验和礼来imlunestrant的Ember-3试验研究一样,giredestrant并不要求先前使用过CDK4/6抑制剂无效,不过它们也将所有受试者的主要终点设计为PFS。
对于罗氏、阿斯利康和礼来三家公司来说,进一步修改研究方案可能为时已晚,除非这些公司在最后一刻决定修改其研究设计的主要终点。而对于其他研究进度稍慢的竞争者来说,这无疑是一个汲取经验、快速赶超的绝佳机会。
Arvinas和Olema是两家分别有口服SERD开发项目ARV-471和OP-1250的小型公司,都还没有开始关键试验的开发。
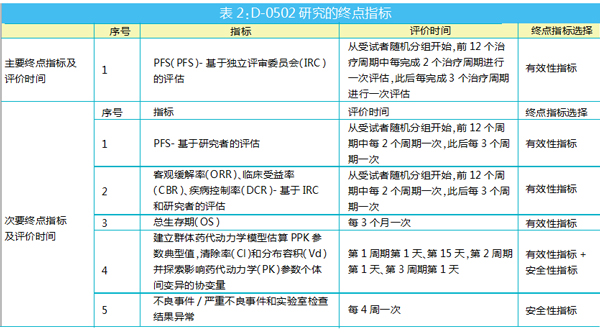
在国内,D-0502是益方生物的自主研发口服SERD/雌激素受体拮抗剂,目前正在中国和美国同步开展国际多中心临床试验。益方生物在国内刚刚启动了一项D-0502治疗局部晚期或转移性乳腺癌的Ⅲ期临床试验。从CDE中国药物临床试验登记与信息公示平台上公布的临床试验方案(登记号:CTR20220511)来看,同样是所有受试者的主要终点设计为PFS。也许Ameera-3研究的数据会给他们在研究设计方面提供重要参考意义。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






