限制性裁决促AD药巨头抱团应对
发布时间:2022-03-23 15:17:14作者:李勇来源:医药经济报
为了改变美国医疗保险和医疗补助服务中心(CMS)对渤健阿尔茨海默病(Alzheimer disease,AD)治疗药物Aduhelm(aducanumab)的限制性裁决,近日,罗氏、礼来为困境中的渤健发出声援。此前,这三家公司还是竞争激烈的对手,如今却罕见地团抱起来。
事情与此前CMS结束的一项提案有关,这项提案将Aduhelm的医疗保险覆盖范围仅限于参加批准的临床试验患者。如果提案通过,这项裁决将不只适用于Aduhelm,还适用于包括礼来和罗氏的基因泰克等其他公司正在开发的抗β淀粉样蛋白单克隆抗体。该提案将于今年4月份定音。
针对这个提案,礼来公司候选药物donanemab药品上市负责人Brandy Matthews敦促CMS根据每个候选药物的证据单独考虑,而不是“一刀切”限制该类别所有药物。
基因泰克的联邦政府事务执行董事David Burt则表示:“CMS将仍在进行Ⅲ期临床试验的抗β淀粉样蛋白纳入这项提案范围内,若这些产品未来获得监管机构批准,那么这项决定可能会影响那些有治疗需求的患者获取药物。”
渤健和卫材同样对此表示异议。两家公司反对广泛禁止抗β淀粉样蛋白单克隆抗体,以拯救Aduhelm和他们合作开发的下一个AD候选药物。
可见,本次提案事件正中AD新药三巨头的软肋。近年来,渤健、罗氏和礼来在AD新药之路上齐头并进,市场反馈如何?他们又采取了什么样的应对态度?
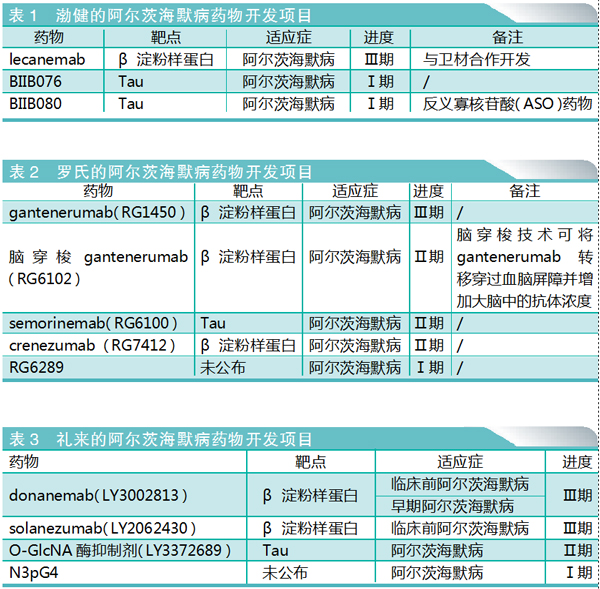
渤健 aducanumab遇冷,三款新药在研
近日,渤健公司报告称,2021年其AD新药Aduhelm的销售额仅为300万美元。该公司表示,Aduhelm去年第四季度的销售额为100万美元,低于市场预期的160万美元,对比当年第三季度,这个缺口已经小多了,当时分析师预计Aduhelm销售额为1210万美元,但实际销售额仅为30万美元。截至2021年12月31日,Aduhelm库存价值约为2.25亿美元。看来以目前的市场销售速度,渤健还面临着销库存的巨大压力。
总之,这对于该药上市前预测的“重磅炸弹”级销售额相去甚远!
常规的新药上市后,制药公司会把主要精力放在产品商业化推广,Aduhelm则与此不同。2021年6月,Aduhelm获得FDA加速批准,作为首款上市的通过减少大脑中的β淀粉样蛋白斑块的AD治疗药物,该药物并没有给渤健带来预期的荣誉和相应收益,相反,渤健一直疲于应对其他问题。
在批评和争议中,2021年7月,FDA批准了Aduhelm注射液100mg/ml溶液的更新标签。该标签建议轻度认知障碍或轻度痴呆症患者使用β淀粉样蛋白靶向抗体,这与渤健晚期试验中包含的患者群体一致。此次标签更新相当于缩窄Aduhelm适用范围。
Aduhelm在欧盟和日本的上市计划也遭受了挫折。
2021年11月,渤健在欧盟收到了对aducanumab药品营销授权申请(MAA)的负面趋势投票。2021年12月,人用药品委员会(CHMP)对aducanumab的MAA采取了否定意见。
2021年12月,渤健和合作伙伴卫材宣布,日本厚生劳动省(MHLW)药物事务和食品卫生委员会新药第一委员会(NDC)决定继续审议aducanumab用于治疗AD的制造和营销批准申请,不过NDC要求其提交其他数据。两家公司表示将继续积极与日本的药品和医疗器械管理局(PMDA)合作,就额外的数据要求达成一致。
此外,渤健有9年的漫长时间来完成对Aduhelm的确认性研究,如果失败将面临从市场上撤出的风险。与此同时,2021年12月20日,渤健宣布希望通过降价(2022年1月1日起降价50%)以提振Aduhelm的销售额,但市场对此反应或许并不乐观。
除了Aduhelm之外,渤健(与卫材合作)开发的AD新药还有3款,包括已经向美国FDA启动提交上市申请的lecanemab。
只是回看去年6月,Aduhelm获得FDA加速批准用于治疗AD患者,仿佛这个屡遭失败的领域已经打开了新治疗方法的闸门。当时业界普遍认为:FDA已经设定了一个新的、更低的标准。生物制药行业的竞争者自然不会放弃这个具有巨大潜力且目前市场竞争尚不激烈的领域。
于是,该领域的参与者重燃新药开发的激情,甚至其他生物制药公司也跃跃欲试。罗氏和礼来被认为是最具实力的竞争者,因为他们不仅有处于晚期即将推向市场的产品,还有处于早期研究阶段的项目。
如今,在看到Aduhelm的表现之后,罗氏和礼来已从渤健“激进而错误”的Aduhelm上市计划中吸取教训:在没有获得真正的有效性证据的情况下寻求产品批准,或将收获惨淡后果。为此,罗氏和礼来正放弃匆忙上市,毕竟获取关键的研究数据更为重要。
罗氏 gantenerumab加速获批成谜,继续低调探索
罗氏下属公司基因泰克正在开发gantenerumab和crenezumab等AD药物,基因泰克希望能够获得相关疗效数据,以求在证明这些药物有效性的问题上一劳永逸。两种候选药物都处于临床测试的不同阶段,其中gantenerumab领先一步,其关键数据预计将在今年下半年发布。
不过,罗氏对gantenerumab能否获得FDA加速批准的态度并不乐观。多年来,他们一直在努力从该项目中获得更强烈的疗效信号:2014年,罗氏Ⅲ期研究失败后将该药物搁置,但怀疑更高的剂量可能会刺激疗效,于是在2018年“复活”该药物研究;不过,华盛顿大学医学院对该药物的第二次研究也失败了。因此,gantenerumab能否获得支持批准所需的临床数据仍有待观察。
礼来 donanemab寻求市场优势,有望年底推出
礼来此前曾暗示对donanemab的申请采取更积极的态度,这得益于去年Ⅱ期临床研究Trailblazer-Alz的积极数据:与安慰剂相比,donanemab使得早期症状性AD患者的认知和日常功能的综合指标下降速度明显减慢。
但在CMS对Aduhelm进行全国覆盖确定之后,礼来决定推迟donanemab的加速批准申请。CMS的医疗保险覆盖率提案草案显然降低了所覆盖患者群,这个消息比礼来希望的加速批准来得更快。
同样,礼来也不会盲目乐观。考虑到渤健的困境,这家大型制药公司去年决定针对Aduhelm进行donanemab的“头对头”临床试验。Donanemab比包括Aduhelm在内的其他类似药物更能减少β淀粉样蛋白,进而可能会给该药带来市场优势。
比较不同的试验总是充满风险,但如果礼来能证明这一论点,这将是donanemab的重大胜利。当然,在将donanemab与Aduhelm的数据进行比较时,前者要显示出优势,才能让礼来有信心进行正面交锋式的试验。礼来预计明年年中将获得donanemab与Aduhelm“头对头”试验的数据。
礼来已提交donanemab以进行加速批准,并预计将在第一季度末完成滚动提交。如果FDA一切按计划进行,该公司的目标是在今年年底前推出donanemab。
小结:渤健、罗氏和礼来都有AD热门靶点β淀粉样蛋白项目进入晚期临床试验阶段,有望在今年申请上市。3款新药能否从Aduhelm吸取经验并实现超越,还有待观察。与此同时,3家公司也在AD另一热门靶点Tau进行着布局,同样值得关注。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






